Correction Sujet Bac Ministère (6 points)
Dosage d'un vinaigre :
I ) 1) CH3COOH(aq) + HO-(aq) = CH3COO-(aq) + H2O(l)
2) a) Qr= [CH3-COO-] / ([CH3COOH ][HO-])
b) à l'équilibre, Qr éq = K , constante d'équilibre
réaction de l'acide avec l'eau : CH3COOH(aq) + H2O(l) = CH3COO-(aq) + H3O+(aq)
KA = [CH3-COO-]éq.[H3O+]éq/ [CH3COOH ]éq
KA
= [CH3-COO-]éq.[H3O+]éq.[HO-]éq/
([CH3COOH]éq.[HO-]éq) = Ke . K
Þ K = KA / Ke = 10-4,8
/ 10-14 = 109,2
c) Le quotient de réaction à l'équilibre d'un système Qr,éq prend
une valeur indépendante de la composition initiale, la constante d'équilibre
K associée à l'équation de la réaction.
3) K > 104 . La réaction est donc totale. Pour servir de réaction de support au dosage, la réaction doit être totale, rapide et unique.
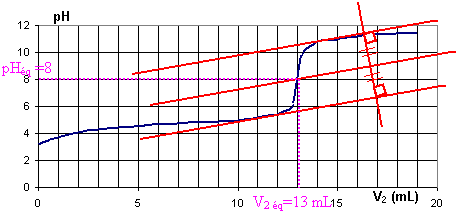
II ) Etude à l'équivalence :
1) On utilise la méthode des tangentes
V2 éq = 13 mL et pHéq = 8
2) A l'équivalence, les réactifs acide et base ont été complètement consommées.
A l'équivalence les espèces majoritaires sont les espèces formées: l'ion éthanoate CH3COO- , l'ion sodium apporté par la soude, les molécules d'eau.
La solution contient une base faible, l'ion éthanoate majoritaire, le pH de la solution est donc supérieur à 7.
3)a) A l'équivalence , les réactifs ont été ajoutés dans les proportions stchiométriques de l'équation : n1 = n2 éq
b) n1 = c1.V1 ; n2,éq
= c2.V2,éq ;
c1.V1 = c2.V2,éq
; ; c1 = c2.V2,éq / V1
c1 =1,0.10-1 x 13 / 10 = 1,3 10-1 mol.L-1
c) On a dilué par 10. c = 10 c1 = 1,3 mol.L-1
III ) Etude d'un point particulier : V2 = V2 éq / 2
1) n1 = c1.V1 = 0,13 x 10.10-3 = 1,3.10-3 mol ; n2 = c2.V2 = 0,10 x 13.10-3/ 2 = 6,5.10-4 mol
2)
|
Equation chimique |
|
CH3COOH(aq)+ HO-(aq) = CH3COO-(aq)+ H2O(l) |
|||
|
Etat du système |
Avancement |
Quantité de |
matière |
En mol |
|
|
Etat initial |
0 |
c1.V1 |
c2.V2 |
0 |
excès |
|
En cours |
x |
c1.V1 - x |
c2.V2 - x |
x |
excès |
|
Etat demi-équiv. |
x ½ |
c1.V1 - x ½ |
c2.V2 - x ½ |
x ½ |
excès |
La réaction est totale. D'après les quantités de réactifs, l'ion HO- est en défaut. c2.V2 - x ½ = 0
x ½ = c2.V2 = 6,5.10-4 mol
n(CH3COO-) = x ½ = c2.V2 = 6,5.10-4 mol ; n(CH3COOH) = c1.V1 - x ½ = 6,5.10-4 mol
3) n(CH3COO-) = n(CH3COOH)
; [CH3COO-] = [CH3COOH] ; KA=[H3O+
] ; pH = pKA =4,8
4) La valeur lue sur la courbe pour V2 = 6,5 mL est voisine de
5, valeur proche de 4,8.
Cela correspond à ce qui est attendu.
©Sciences Mont Blanc