1eS - Chap 02 : Solutions électrolytiques ![]()
I ) Les cristaux ioniques :
Un solide ionique est une espèce chimique neutre composé d’anions et de cations.
Exemple : Le chlorure de sodium NaCl est présent dans l’eau de mer (dissous) et à l’état de solide dans certains gisements.
Grâce aux rayons X, on peut établir la structure des cristaux de NaCl.
Ils sont constitués d’un empilement régulier d’ions, que l’on représente par des sphères, une petite sphère pour Na+ et une grosse sphère pour Cl- .

Chaque ion Cl- est entouré de 6 ions Na+ et chaque ion Na+ est entouré de 6 ions Cl- .
Cette maille représente le motif périodique du cristal qui se reproduit identique dans les trois dimensions du cristal.
La cohésion de l’édifice est assurée par de fortes interactions électrostatiques coulombiennes attractives (entre tous les anions et les cations du cristal).
Cet ensemble d’interactions électrostatiques définit la liaison ionique.
Conséquence :
* Le cristal NaCl est très solide. Il faut fournir beaucoup d’énergie pour le disloquer.
* Sa température de fusion est élevée : θf = 800°C
Dans un cristal ionique, les ions ne sont pas mobiles, il n’y a pas d'électrons libres, il n'y a donc pas de transport d’électricité.
Il est donc un isolant électrique
De nombreux solides minéraux sont faits d’un empilement régulier d’anions et de cations.
Lire doc. p24 et p25
II ) Polarité d’une molécule :

1) Electronégativité des éléments :
Certains éléments ont tendance à capter les électrons pour former des ions négatifs.
Le Fluor est celui qui capte le plus facilement un électron.
D’autres éléments retenant moins les électrons donnent facilement les ions positifs.
Le sodium Na et le potassium K donnent facilement Na+ et K+ .
Les atomes qui captent facilement des électrons sont très électronégatifs.
Ils sont en haut et à droite dans le tableau des éléments.
Ceux qui perdent facilement des électrons sont peu électronégatifs.
Ils sont en bas et à gauche dans le tableau des éléments.
2) Polarisation d’une molécule :
Une liaison covalente entre 2 atomes résulte de la mise en commun par chaque atome d’un électron de sa couche électronique externe.
Dans une molécule comportant 2 atomes différents, le plus électronégatifs attire plus les électrons du doublet de la liaison vers lui.
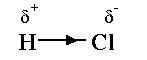 C’est le cas dans
la molécule HCl : l’atome de Chlore, plus électronégatif que l’Hydrogène,
a ainsi un excès de charges négatives ( δ-
), tandis que l’Hydrogène a une charge ( δ+
).
C’est le cas dans
la molécule HCl : l’atome de Chlore, plus électronégatif que l’Hydrogène,
a ainsi un excès de charges négatives ( δ-
), tandis que l’Hydrogène a une charge ( δ+
).
La molécule est polarisée ou polaire.
Au contraire, une molécule avec 2 atomes identiques n’est pas polarisée, elle est apolaire.
Exemple : H—H molécule de dihydrogène
Du point de vue électrostatique, une molécule polaire se comporte comme 2 charges ponctuelles opposées, comme un dipôle électrostatique.
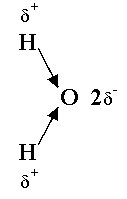 3) La molécule
d’eau :
3) La molécule
d’eau :
L’atome d’oxygène est plus électronégatif que l’atome d’Hydrogène.
Les liaisons O—H sont donc polarisées. Si la molécule était linéaire, les 2 dipôles électriques se compenseraient et la molécule serait apolaire.
Mais la molécule est coudée .
Le caractère dipolaire d’une molécule dépend non seulement de la polarisation des liaisons mais également de la géométrie de la molécule.
On peut montrer le caractère dipolaire de l’eau en chargeant positivement un bâton de verre avec un tissu puis en l’approchant d’un fin filet d’eau.
Il va l’attirer.
III ) Solutions électrolytiques :
1) Dissolution de gaz
a) Gaz chlorure d’hydrogène dans l’eau :
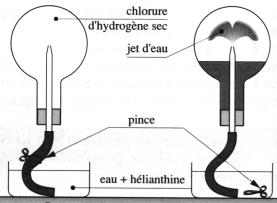 * Expérience du jet d’eau :
* Expérience du jet d’eau :
Dans le ballon contenant le gaz HCl, introduire de l'eau distillée avec
une pissette dans le tuyau, agiter puis retourner le ballon sur le cristallisoir
plein d'eau : un jet d'eau jaillit dans le ballon.
La solution dans le ballon est rose.
* Interprétation :
Quand on met quelques gouttes d'eau dans le ballon, il y
a dissolution de HCl dans l'eau, le volume de gaz diminue ainsi que la pression,
l'eau monte ainsi dans le ballon.
L'hélianthine est un indicateur coloré, rose en milieu acide
et jaune en milieu basique.
(On peut aussi utiliser du BBT (jaune en milieu acide et bleu en milieu basique)).
La coloration rose indique que le milieu est acide, il y a présence
d'ions H+ .
En ajoutant une solution de nitrate d'argent (Ag+ , NO3- ) , il se forme un
précipité blanc qui noircit à la lumière indiquant
la présence d'ions chlorure Cl-.
HCl est un gaz très soluble dans l’eau : H-Cl → H+aq + Cl-aq
* Interaction des molécules en solution :
H- Cl χ(H) = 2,2 ; χ(Cl) = 3,2
Cl est plus électronégatif que H ⇒ la liaison est polarisée : H - Cl
+δ -δ
La molécule constitue un dipôle électrostatique.
(ensemble de 2 charges opposées -q et +q , non confondues)
La molécule HCl est polaire. De même, la molécule H2O est polaire
La molécule d’eau et de HCl interagissent, grâce aux attractions entre molécules de signes opposés.
L’hydrogène de H-Cl va même se lier à H2O : H-Cl + H2O → H3O+ aq + Cl- aq
b) Gaz carbonique dans l’eau :
Verser dans un tube, de l’hydrogénocarbonate de sodium et de l’acide éthanoïque puis boucher avec un tube à dégagement plongeant dans l’eau distillée.
Ensuite , verser de l’eau de chaux dans la solution. Un trouble blanc indique la présence de gaz carbonique dissous.
-2 δ +4δ -2 δ
O=C=O symétrique et linéaire
Les deux dipôles se neutralisent, la molécule n’est pas polaire et elle est peu soluble dans l’eau.
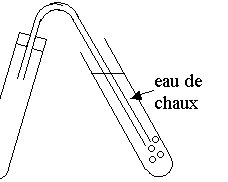
L’eau de chaux se trouble mais beaucoup de bulles vont vers la surface.
CO2 est peu soluble dans l’eau.
Applications : boissons gazeuses
c) L’ammoniac :
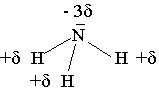 L’ammoniac
est un gaz de formule NH3 .
L’ammoniac
est un gaz de formule NH3 .
La molécule a la forme d’une pyramide et l’atome d’azote est plus électronégatif que H.
La molécule d’ammoniac est polaire. Ici les dipôles ne se compensent pas à cause de la forme.
NH3 est très soluble dans l’eau : on peut faire la même expérience du jet d’eau qu’avec HCl.
Remarque : une solution de NH3 s’écrit solution d’ammoniaque.
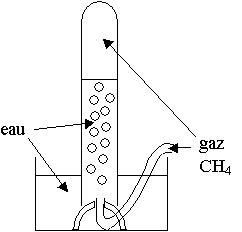
d) Le méthane : CH4 :
Pour tester la solubilité du gaz , on le fait buller dans l'eau.
On constate qu'il monte sans se dissoudre.
Le méthane est insoluble dans l’eau
χ(C) = 2,5 , χ(H) = 2,2
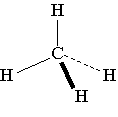 La liaison C-H
est peu polarisée, mais la géométrie symétrique de la molécule annule les
petites polarités des liaisons.
La liaison C-H
est peu polarisée, mais la géométrie symétrique de la molécule annule les
petites polarités des liaisons.
La molécule CH4 n’est pas polaire.
e) Dissolution d’autres gaz :
* NO2 , SO2 → pluies acides
* dioxygène → poissons
2) Dissolution d’un cristal ionique dans l’eau :
Une solution ionique est obtenue par dissolution d’un solide ionique appelé soluté dans le solvant eau. Elle est constituée d’anions et de cations dispersés et en mouvement parmi de très nombreuses molécules d’eau.
Les ions sont des charges mobiles dans l’eau.
Une solution ionique ou électrolytique conduit le courant électrique.
Mise en évidence :
Matériel : un électrolyseur, un générateur 6 V , une ampoule, des fils , de l’eau distillée et du sel.
Expérience : 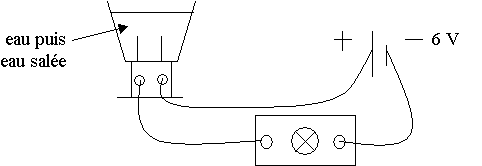
3) Etapes d’une dissolution :
Un cristal ionique ou électrolyte se dissout en 3 étapes : dissociation , solvatation, dispersion.
La dissociation des ions est due à l’action électrostatique attractive des molécules d’eau.
La solvatation ( ici hydratation) : les ions s’entourent de molécules d’eau. Ces ions hydratés sont noté Na+ (aq) ou Cl- (aq).
La dispersion : Les ions hydratés se dispersent dans la solution. Cela est accéléré si on agite, la solution devient alors peu à peu homogène.
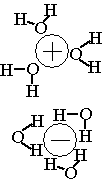
hydratation :
O porte une charge -2 δ, l’eau va donc entourer les cations, les hydrater.
H porte une charge + δ , l’eau va donc entourer les anions, les hydrater.
4) Saturation :
On ne peut pas dissoudre une quantité infinie de solide dans un volume d’eau donné.
Il existe une quantité maximale de soluté que l’on peut dissoudre dans un solvant, on l’appelle solubilité.
Elle dépend du solvant et de la température.
5) L’ion Hydrogène H+ , le proton :
C’est un atome Hydrogène qui a perdu un électron. Il ne reste plus alors que le proton du noyau. L’ion H+ va s’hydrater en solution mais aussi former une véritable liaison avec une molécule d’eau pour former l’ion oxonium H3O+ , lui-même hydraté.
6) Equation chimique d’une dissolution :
 Il s’agit d’une
transformation chimique à laquelle on associe une équation chimique .
Il s’agit d’une
transformation chimique à laquelle on associe une équation chimique .
Exemples :
NaCl(s) → Na+ (aq) + Cl- (aq)
HCl (g) → H+ (aq) + Cl- (aq)
H2SO4 (l) → 2 H+ (aq) + SO42- (aq)
H2SO4 est très soluble dans l’eau et sa dissolution est très exothermique.
H2SO4 + 2 H2O → 2 H3O+aq + SO4 2 -
ion oxonium
Danger : JAMAIS D’EAU DANS L’ACIDE ( ON VERSE TOUJOURS L’ACIDE DANS L’EAU)
7) Conclusion :
Une solution électrolytique est un liquide conduisant le courant grâce à des ions mobiles.
Un composé moléculaire est soluble dans l’eau, solvant polaire, s’il est lui-même polaire et s’il peut établir des liaisons hydrogène avec les molécules d’eau.
IV) Concentrations :
1) Concentration de soluté apporté :
Elle est notée c. csoluté apporté = n soluté apporté / V solution
exemple : on dissout 3,0 mol de chlorure de calcium CaCl2 dans 500 mL d’eau
cCaCl2 = n CaCl2 / V solution = 3,0 / 0,500 = 6,0 mol.L-1
2) Concentration des espèces présentes en solution :
c se réfère à ce qui a été introduit dans le solvant et non pas à ce qui est présent dans la solution.
On note [X], la concentration d’une espèce X présente en solution. [X] = nX / Vsolution
exemple 1 : CaCl2 (s) → Ca2+ (aq) + 2 Cl –(aq)
[Ca2+ ] = c = 6 mol.L-1 ; [Cl - ] = 2 c = 12 mol.L-1
exemple 2 :
On verse 2 mol d’acide sulfurique H2SO4 liquide pur dans 200 mL d’eau
cH2SO4 = 2 / 0,2 = 10 mol.L-1
H2SO4 (l) → 2 H+ (aq) + SO42- (aq)
[H+(aq) ] = 2c = 20 mol.L-1 ; [SO4 2-(aq) ] = c = 10 mol.L-1
3) Dilution :
Lors d’une dilution d’une solution électrolytique, on prélève un volume V de la solution mère de concentration c, on ajoute de l’eau pour préparer un volume V’, solution fille de concentration c’. Les quantités de matière ne changent pas avant et après dilution.
n = n’ ⇒ c . V = c’ . V’ (vu en 2nde)
On peut l’étendre aux concentrations des espèces présentes : [X] .V = [X]’. V’
Exercice 1 : On dissout 0,40 g de sel NaCl dans 100 mL d’eau salée de concentration
cNaCl = 1,0.10-2 mol.L-1 . Calculer [Na+] et [Cl-] . M(Na) = 23 g.mol-1 ; M(Cl) = 35,5 g.mol-1
* dans l’eau salée :
[Na+]0 = [Cl-]0 = cNaCl = 1,0.10-2 mol.L-1 ( dissolution : NaCl Na+ + Cl- )
n(Na+)0 = n(Cl-)0 = c . V = 1,0.10-2 x 0,100 = 1,0.10-3 mol
* sel dissous :
n(NaCl)1 = m / M = 0,40 / ( 23 + 35,5) = 6,8.10-3 mol
n(Na+)1 = n(Cl-)1 = n(NaCl)1 = 6,8.10-3 mol
* solution finale :
[Na+] = [Cl-] = (n1 + n2) / V = (1,0.10-3 + 6,8.10-3 ) / 0,100 = 7,8.10-2 mol.L-1
Exercice 2 : (sans calculatrice !!!)
On dissout 0,12 L de gaz HCl dans 200 mL de solution d’acide chlorhydrique de concentration c = 1,0.10-2 mol.L-1 dans les conditions où Vm = 24 L.mol-1
Calculer les concentrations des ions en solution.
n(H+) = VHCl / Vm + c.V = 0,12 / 24 + 1,0.10-2 x 0,200 = 5,0.10-3 + 2,0.10-3 = 7,0.10-3 mol
dissolution : HCl H+ + Cl- ; n(H+) = n(Cl-)
[H+] = [Cl-] = n / V = 7,0.10-3 / 0,200 = 3,5.10-2 mol.L-1
©Sciences Mont Blanc

