Correction du contrôle 2nde - moles et grandeurs molaires
Ex 1 :
M1 = M(C57H104O6) = 57 MC+104 MH+6 MO= 57 x 12,0 + 104 x 1,00 + 6 x 16,0 = 884 g.mol-1
Dans la bouteille : n1 = m1 / M1 = 690 / 884 = 0,78 mol. . Dans la fiole, n2 = 0,50 mol
n1 > n2 . La bouteille contient plus d’huile, elle est donc plus intéressante pour le même prix.
Volume d’huile dans la bouteille : V1 = m1 / ρ = 690 / 0,92 = 750 mL = 0,75 L
Ex 2 :
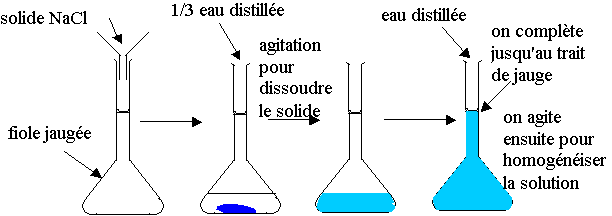
1) Le chlorure de sodium se nomme couramment du sel.
2) M(NaCl) = MNa + MCl = 23 + 35,5 = 58,5 g.mol-1 ; m(NaCl) = n x M
n(NaCl) = c x V = 2,0.10-2 x 0,100 = 2,0.10-3 mol
m(NaCl) = n x M = 2,0.10-3 x 58,5 = 0,12 g
3) Lors d'une dilution, la quantité de matière de soluté est la même avant et après dilution :
navant = naprès ⇒ c0 . V0 = c1.V1 , V0 étant le volume à prélever de solution mère.
V0 = c1 . V1 / c0 = 4,0.10-3 x 0,200 / 2,0.10-2 = 0,040 L = 40 mL ( V0 est bien inférieur à V1 )
Ex 3:
a) M(C6H8O6) = 6 MC + 8 MH + 6 MO= 6 x 12,0 + 8 x 1,00 + 6 x 16,0 = 176 g.mol-1
M(C6H22O11) = 6 MC + 22 MH + 11 MO= 6 x 12,0 + 22 x 1,00 + 11 x 16,0 = 270 g.mol-1
n(C6H8O6) = m(C6H8O6) / M(C6H8O6) = 1,76 / 176 = 0,010 mol
n(C6H22O11) = m(C6H22O11) / M(C6H22O11) = 5,40 / 270 = 0,020 mol
b) c(C6H8O6) = n(C6H8O6) / Vsolution = 0,010 / 0,125 = 0,080 mol.L-1
c(C6H22O11) = n(C6H22O11) / Vsolution = 0,020 / 0,125 = 0,16 mol.L-1
Ex 4 :
a) V(C2H6) = n(C2H6) x Vm = 12,4 x 24 = 3,0.102 L
b) M(C2H6) = 2 MC + 6 MH = 2 x 12,0 + 6 x 1,00 = 30,0 g.mol-1
m(C2H6) = n(C2H6) x M(C2H6) = 12,4 x 30,0 = 3,7.102 g
Ex 5 :
a) M(C2H6O) = 2 MC + 6 MH + MO = 2 x 12,0 + 6 x 1,00 + 16,0 = 46,0 g.mol-1
m(C2H6O) = n x M = 0,50 x 46,0 = 23 g ; V(C2H6O) = m / ρ = 23 / 0,79 = 29 mL
b) On cherche le volume V d’alcool à 90° contenant 29 mL d’éthanol pur.
On sait que 1000 mL d’alcool à 90° contient 900 mL d’éthanol pur.
On fait un produit en croix : V / 1000 = 29 / 900 ; V = 29 x 1000 / 900 = 32 mL
Ex 6 : Les ions hydroxydes viennent de la solution 1 :
n(HO-) = c1 x V1 = 1,00.10-3 x 0,070 = 7,0.10-5 mol
Les ions chlorures viennent de la solution 2 : n(Cl-) = c2 x V2 = 1,3.10-3 x 0,170 = 2,2.10-4 mol
Les ions sodium viennent des 2 solutions :
n(Na+) = c1 x V1 + c2 x V2 = 7,0.10-5 + 2,2.10-4 = 2,9.10-4 mol
©Sciences Mont Blanc



