Correction Concours d’entrée Masso-Kinéthérapie
Lariboisiere et St Maurice - Mai 2004
 I
) L’aspirine, un antalgique célèbre :
I
) L’aspirine, un antalgique célèbre :
I ) Les groupes fonctionnels :
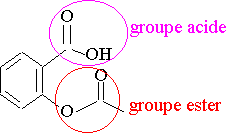
1) La molécule comporte un groupe acide carboxylique et un groupe ester
2) En ajoutant des ions hydroxyde HO- , on peut hydrolyser l’ester , la fonction ester est remplacée par une fonction alcool, et obtenir la base conjuguée du groupe acide par réaction acido-basique.
Ces transformations se font par chauffage avec un montage à reflux.
II ) Couple acide/base
1) La base conjuguée de l’acide est CH3–COO–C6H4–COO-
2) CH3–COO–C6H4–COOH + H2O = CH3–COO–C6H4–COO- + H3O+
K = Qr éq = [CH3–COO–C6H4–COO-]éq.[H3O+]éq/ [CH3–COO–C6H4–COOH]éq = KA = 10-3,5
( on considère ici l’eau comme un solvant)
La constante d’équilibre est faible, le taux d’avancement est donc faible, la base conjuguée se forme en faible quantité.
3) [CH3–COO–C6H4–COO-]éq / [CH3–COO–C6H4–COOH]éq = KA / [H3O+]éq
Si pH > pKA , la base conjuguée est donc prédominante, c’est le cas dans l’intestin.
Si pH < pKA , l’acide est prédominant, c’est le cas dans l’estomac.
III ) Préparation de l’aspirine :
1) Cette réaction est une estérification. C’est le groupe alcool de l’acide salicylique qui réagit.
D’après la formule de l’aspirine, il faut de l’acide éthanoïque (acétique) pour cette estérification.
2) On peut utiliser un anhydride d’acide , ici l’anhydride éthanoïque . Le but est d’améliorer le rendement de la transformation en empêchant l’hydrolyse de l’ester de se faire ( il n’y a pas de formation d’eau), on a ainsi une réaction totale et rapide.
IV) Titrage directe de l’aspirine :
masp = 0,350 g ( sur l’étiquette pour un comprimé )
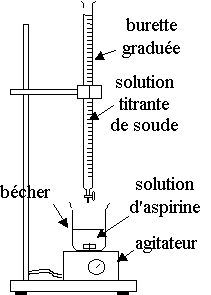 1)
Montage de dosage :
1)
Montage de dosage :
2) Equation du dosage : HA(aq) + HO-(aq) ® A-(aq) + H2O(l)
3) A l’équivalence, les réactifs HA et HO- ont été mélangés dans les proportions stoechiométriques de l’équation et ont donc été complètement consommés, il reste donc dans le mélange réactionnel, de l’eau et la base conjuguée A-, ce mélange est donc basique, son pH est supérieur à 7
4) A l’équivalence : n(HA)0 = n(HO-)versé éq ; CS.V0 = CB.VEq
CS = CB.VEq / V0 = 5,0.10-2 x 7,7.10-3 / 20,0.10-3 = 0,019 mol.L-1
5) nasp = CS.VS = 0,019 x 100,0.10-3 = 1,9.10-3 mol ; masp = nasp.Masp = 1,9.10-3 x 180 = 0,346 g
Ce résultat est très proche de l’indication de l’étiquette, la différence peut s’expliquer par des erreurs expérimentales lors du dosage (lecture) ou par une réelle différence de masse d’aspirine dans le comprimé.
II ) Etude d’une pile zinc – argent :
I ) Sens d’évolution spontanée du système :
1) Zn(s) + 2 Ag+(aq) = Zn2+(aq) + 2 Ag(s)
2) a) Qr, i = [Zn2+]i / [Ag+]i2 = C2 / C12 = 0,10 / 0,202 = 2,5
b) Qr, éq = [Zn2+]éq / [Ag+]éq 2 = K = 1,0.1052
Qr, i < K Þ Le système évolue dans le sens direct de l’équation.
c) La transformation chimique qui a lieu dans une pile est spontanée.
L’équation est donc dans le même sens : Zn(s) + 2 Ag+(aq) = Zn2+(aq) + 2 Ag(s)
d) A l'électrode de zinc : Zn(s) = Zn 2+(aq) + 2 e- A l'électrode d'argent : Ag+(aq) + e- = Ag(s)
e) notation symbolique : - Zn / Zn2+ // Ag+ / Ag Å
 II
) Pile en fonctionnement :
II
) Pile en fonctionnement :
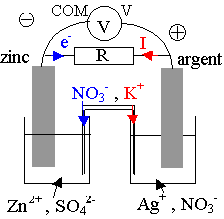
1) Si on branche uniquement le voltmètre aux bornes de la pile, celui-ci indique sa f.e.m, tension à vide E et la pile ne fonctionne pas, elle ne débite aucun courant ( le voltmètre se comporte comme un interrupteur ouvert ). En branchant un conducteur ohmique ou un circuit aux bornes de la pile, celle-ci fournit du courant, qui circule dans le circuit de la borne + de la pile vers la borne - .
Des ions Zn 2+ dans le bécher de gauche sont formés, il faut donc compenser avec des ions NO3- du pont salin pour assurer la neutralité de la solution. De même, dans l'autre bécher, des ions Ag+ sont consommés, des ions K+ du pont salin doivent être ajoutés.
Ces ions K+ et NO3- sont les porteurs de charge dans le pont salin. Dans les solutions, les ions Ag+ migrent vers l'électrode d'argent ; les ions nitrates migrent en sens contraire ; les ions Zn2+ s'éloignent de l'électrode de zinc; les ions sulfates migrent en sens contraire. Dans le circuit, ce sont les électrons, qui circulent en sens inverse du courant.
2) I = 0,965 A pendant Dt = 5 min = 300 s
A l'électrode de zinc : Zn(s) = Zn 2+(aq) + 2 e- . n(Zn 2+ )formé = n(e- ) / 2
Q = n(e- ).F = I . Dt = 0,965 x 300 = 289 C ; n(e- ) = Q / F = 3,00.10-3 mol ;
n(Zn 2+ )formé = 3,00.10-3 / 2 = 1,50.10-3 mol ; n(Zn 2+ )final = n(Zn 2+ )0 + n(Zn 2+ )formé
n(Zn 2+ )final = C2.V2 + n(Zn 2+ )formé = 0,10 x 100,0.10-3 + 1,50.10-3 = 0,0115 mol
[Zn2+]f = n(Zn 2+ )final / V2 = 0,0115 / 100,0.10-3 = 0,115 mol.L-1
A l'électrode d'argent : Ag+(aq) + e- = Ag(s) ; n(Ag+ )consommé = n(e- ) = 3,00.10-3 mol
n(Ag+ )final = C1.V1 - n(Ag+ )consommé = 0,20 x 100,0.10-3 – 3,00.10-3 = 0,017 mol
[Ag+]f = n(Ag+)final / V1 = 0,017 / 100,0.10-3 = 0,17 mol.L-1
3) m(Ag)0 = mAg . V = 7,1 x 10,0 = 71 g ; m(Zn)0 = mZn . V = 10,3 x 10,0 = 103 g
n(Ag)formé = n(e- ) = 3,00.10-3 mol ; m(Ag)formé = n.M = 3,00.10-3 x 107,9 = 0,324 g
m(Ag)final = m(Ag)formé + m(Ag)0 = 71,3 g
n(Zn)consommé = n(e-) / 2 = 1,50.10-3 mol ; m(Zn)consommé = n.M = 1,50.10-3 x 65,4 = 0,098 g
m(Zn)final = m(Zn)0 - m(Zn)consommé » 103 g. Ces masses ont peu changé.
©Sciences Mont Blanc