Sujet Bac - Ministère - Dosage d'un vinaigre (6 points) Calculatrice autorisée
On se propose de doser par pH-mètrie un vinaigre afin d'en déterminer la concentration molaire volumique en acide éthanoïque.
Pour cela, on prépare V = 100 mL d'une solution diluée 10 fois du vinaigre.
Puis on prélève un volume V1 = 10 mL de la solution diluée que l'on verse dans un bécher, auquel on ajoute suffisamment d'eau distillée pour immerger correctement la cellule du pH-mètre.
On réalise le dosage avec une solution d'hydroxyde de sodium
de concentration molaire volumique
c2 = 1,0.10-1 mol.L-1.
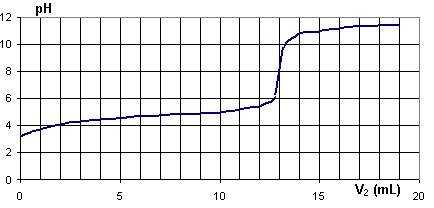
Le pH est relevé en fonction du volume V2 de solution d'hydroxyde de sodium et on obtient la courbe pH = f(V2) donnée ci-dessous .
Toutes les solutions considérées sont prises à 25°C.
Donnée : pKa du couple CH3COOH / CH3COO- à 25 °C : 4,8 et pKe = 14.
I ) Réaction support du dosage :
1) Ecrire l'équation chimique associée à la transformation chimique étudiée [0,25 pt]
2) a) Exprimer le quotient de réaction Qr de cette réaction. [0,5 pt]
b) Quelle valeur particulière ce quotient de réaction prend-il dans l'état d'équilibre du système ? Calculer cette valeur. [0,5 pt]
c) Cette valeur dépend-elle de la composition initiale du système ? [0,25 pt]
3) Quelle hypothèse faut-il faire sur la nature de la transformation chimique pour que la réaction puisse servir de support au dosage ? [0,25 pt]
II ) Etude à l'équivalence :
1) Déterminer graphiquement les coordonnées du point d'équivalence acido-basique en utilisant le graphe donné pH = f(V2) . [0,5 pt]
2) Quelles sont les espèces chimiques majoritaires à l'équivalence ? [0,5 pt]
3) a) On note n1 la quantité de matière de réactif titré initialement apporté dans le bécher et n2,éq la quantité de matière de réactif titrant versé à l'équivalence.Etablir la relation liant n1 et n2éq.[0,25pt]
b) En déduire la concentration c1 en acide éthanoïque apporté dans la solution diluée [0,5 pt]
c) Calculer la concentration c en acide éthanoïque du vinaigre. [0,5 pt]
III ) Etude d'un point particulier
On se place dans la situation où on a versé un volume d'hydroxyde de sodium représentant la moitié du volume versé à l'équivalence.
1) Quelles sont les quantités
d'hydroxyde de sodium et d'acide éthanoïque introduites ? [0,5 pt]
2) A l'aide d'un tableau descriptif de l'évolution du système, déterminer
la quantité d'ion éthanoate alors formé, ainsi que la quantité d'acide éthanoïque
restant dans le milieu réactionnel. [0,75
pt]
3) En déduire la valeur du pH en ce point. [0,25 pt]
4) Comparer la valeur du pH ainsi trouvée avec la valeur du pH lue sur la courbe de dosage. Commenter.
[0,5 pt]
©Sciences Mont Blanc