Correction Sujet complémentaire Bac – Ministère – Suivi
spectrophotoétrique
Questions :
1) MnO4-(aq) + 5 e- + 8 H+(aq) = Mn2+(aq) + 4 H2O(l) ) x 2
H2C2O4 (aq) = 2 CO2 (g) + 2 e- + 2 H+(aq) ) x 5
2 MnO4-(aq) + 5 H2C2O4 (aq) + 6 H+(aq) = 2 Mn2+(aq) + 8 H2O(l) + 10 CO2 (g)
2) n(H2C2O4 )i = C2.V2 = 1,0.10-4 mol ; n( MnO4-)i = C1.V1 = 1,0.10-5 mol
Si H2C2O4 est en défaut , n(H2C2O4 )f = 0 = n(H2C2O4 )i – 5 xmax
Þ xmax = n(H2C2O4 )i / 5 = 2,0.10-5 mol
Si MnO4- est en défaut , n(MnO4- )f = 0 = n(MnO4-)i – 2 xmax
Þ xmax = n(MnO4-)i / 2 = 5,0.10-6 mol
MnO4- est donc en défaut et H2C2O4 est en excès.
3)
4) La vitesse volumique v de la réaction est définie par la relation : v = (1/V).dx/dt
A = 2000.[MnO4-] ; [MnO4-] = n(MnO4-) / V = (n(MnO4-)0 – 2 x) / V
dA/dt = 2000. d[MnO4-]/dt = - (4000 / V) . dx/dt = - 4000 v
v = - (1 / 4000) . dA/dt
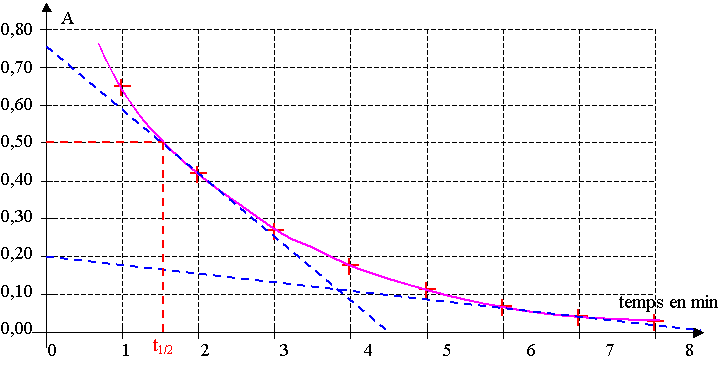
5) D'après le graphique, (dA/dt)2 min = (0,75 – 0)/(0 – 4,5) = - 0,167. v2 min = 4,2.10-5 mol.L-1.min-1
(dA/dt)7 min = (0,2 – 0)/(0 – 9,5) = - 0,021. v7 min = 5,2.10-6 mol.L-1.min-1
v2 min > v7 min . Cela est confirmé par le graphique, la pente est plus forte à 2 min qu'à 7 min.
6) A0 = 2000.[MnO4-]0 = 2000.C1.V1 / (V1+V2) = 2000 C1 / 2 = 2000 x 1,0.10-3 / 2 = 1,0
7) [MnO4-]1/2 = [MnO4-]0 / 2 = 2,5.10-4 mol.L-1 . A1/2 = 2000.[MnO4-]1/2 = 0,50
8) D'après le graphique, t1/2 = 1,5 min pour A = 0,50
©Sciences Mont Blanc