Chap 4 : La spectrophotométrie (A.2) ![]()
I ) Intérêt :
La spectrophotométrie permet, entre autre:
➢ De titrer une espèce en solution lorsque cette espèce colore la solution,
➢ De suivre une cinétique chimique lente.
II ) Les spectres lumineux et la couleur des solutions (Rappels) :
1) Spectre d'émission continu d'une lampe à incandescence :
La lumière blanche émise par le soleil ou par une lampe à incandescence peut être analysée par un prisme ou par un réseau.
Sur l'écran on observe un spectre continu. Dans le domaine visible, ce spectre s'étale du violet (longueur d'ondeλ v = 400 nm) jusqu'au rouge (longueur d'onde λr = 800 nm) :

Remarque 1 : Le spectre électromagnétique
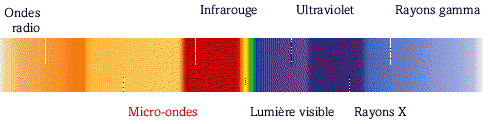
En fait, le spectre de la lumière visible fait partie du spectre électromagnétique beaucoup plus vaste s'étendant du rayonnement gamma (longueur d'onde pouvant descendre en dessous 10-13m
jusqu'au rayonnement hertzien (longueur d'onde pouvant dépasser 10 4 m ).
L'il humain n'est donc sensible qu'à un tout petit domaine des ondes électromagnétiques. L'homme, cependant, utilise de nombreuses sources de radiation non visibles.
Les rayons gamma permettent de traiter certaines tumeurs.
Les rayons X sont utilisées en radiographie (squelette osseux, dentition, bagages).
La radio, le radar et la télévision émettent des ondes hertziennes. Le soleil nous réchauffe avec les radiations infrarouge et nous fait bronzer avec le rayonnement ultraviolet. Les micro-ondes font fonctionner les téléphones cellulaires et les fours à micro-ondes.
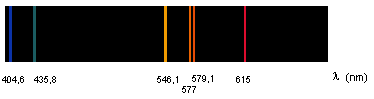
Remarque 2 : Si on remplace la lampe à incandescence par une lampe à vapeur de mercure le prisme donne alors, non pas un spectre continu, mais un spectre de raies :
2) Spectre d'absorption d'une espèce en solution :
Une espèce en solution, éclairée par de la lumière blanche, est susceptible d'absorbée, au moins en partie, l'énergie correspondant à certaines radiations.
La lumière transmise ne sera plus blanche mais colorée.
On peut l'analyser avec un prisme, le spectre obtenu est un spectre d'absorption.
➢ Plaçons dans le montage déjà utilisé une cuve en verre transparent contenant une solution aqueuse de béta-carotène.
 Avec le béta-carotène,
le spectre présente une bande d'absorption vers les courtes longueurs d'onde
:
Avec le béta-carotène,
le spectre présente une bande d'absorption vers les courtes longueurs d'onde
:

Les radiations violettes, bleues et une partie des radiations vertes (bande d'absorption entre 400 et 500 nm) sont absorbées par la solution de béta-carotène.
Cette solution a donc la couleur orange de la carotte. Cette couleur de la solution, observée par transmission, résulte de la superposition sur la rétine de l'il humain des radiations non absorbées (longueurs d'onde comprises entre 500 et 800 nm).
Autres exemples :
➢ Une solution de permanganate de potassium est magenta.
Son spectre présente une large bande noire d'absorption dans l'orange, le
jaune et le vert.
La superposition des couleurs rouge et bleue transmises donne la sensation
de magenta.
➢ Une solution de dichromate de potassium est jaune-orangé. On constate dans le spectre des bandes noires d'absorption dans le violet, le bleu et une partie du vert. La superposition des couleurs transmises rouge, jaune et un peu de vert donne cette teinte orangée.
Si toutes les radiations du domaine visible sont totalement absorbées alors la solution est noire.
Si toutes les radiations du domaine visible sont transmises alors la solution est transparente.
L'eau pure est un liquide transparent.
III ) Principe de la spectrophotométrie : lire p 334 et 335
Le spectrophotomètre fait passer une radiation (lumière) monochromatique (une seule longueur d'onde) à travers une longueur l (longueur de la cuve du spectrophotomètre) de solution et mesure l'absorbance A (grandeur liée à la quantité de lumière absorbée par la solution).

L'absorbance dépend de la couleur de la radiation, de sa longueur d'onde
Soit I0 l'intensité de la lumière incidente et I l'intensité de la lumière transmise.
Le spectrophotomètre compare I et I0 à travers soit la transmittance T ( T = I / I0 ) ou l'absorbance A = - Log T.
Si l'énergie associée à la radiation de longueur d'onde λ1 n'est pas du tout absorbée par la solution étudiée alors A(λ1) = 0.
L'énergie est transmise à 100 / 100 = 1 = 10 0.
Si l'énergie associée à la radiation de longueur d'onde λ2 est absorbée à 99 % par la solution étudiée alors A(λ2) = 2.
L'énergie est transmise à 1 / 100 = 0,01 = 10 - 2.
Il faut régler le zéro en plaçant le solvant dans la cuve et l'absorbance doit être nulle.
Connaissant le spectre d'absorption d'une espèce chimique, on peut mesurer, à l'une de ces longueurs d'onde, les variations de l'intensité I d'un faisceau lumineux traversant une même épaisseur L de solution en fonction de la concentration.
Ceci permet d'établir expérimentalement la courbe A = f (C) reliant l'absorbance et la concentration de la substance étudiée (à L et λ constantes), en effectuant les mesures de A pour diverses concentrations. Cette courbe est une courbe d'étalonnage.
La courbe expérimentale d'étalonnage permet de déterminer la concentration inconnue d'une solution de cette substance par mesure de son absorbance et report sur la courbe A = f (C)
La loi de Beer-Lambert donne :
|
|
A = ε. d . C |
avec |
A : absorbance de la solution (sans unité) |
ε dépend de la nature de la solution et de la longueur d'onde
On retiendra simplement que : A = k . C
IV ) Titrage spectrophotométrique :


➢ On recherche le maximum d'absorption pour l'espèce
chimique
➢ On trace la courbe d'étalonnage A = f(C) à l'aide de solutions de
concentrations connues.
➢ On place la cuve contenant la solution à titrer dans le spectrophotomètre et on mesure AS. On lit alors graphiquement CS sur la courbe d'étalonnage.
V ) Suivi d'une cinétique chimique lente :
➢ On place le milieu réactionnel dans le spectrophotomètre et on relève A au cours du temps,
➢ On utilise la droite d'étalonnage A = f(C) pour déterminer la concentration au cours du temps,
➢ On déduit x = f(t) des concentrations en fonction du temps à l'aide du tableau d'avancement,
➢ On trace x = f(t).
L'ordinateur réalise tous les calculs nécessaires et donne x = f(t) à partir des mesures d'absorbance.
©Sciences Mont Blanc

