Exercices Chap 03 – Suivi temporel d'une transformation :
vitesse de réaction ![]()
ex 5 p 61
a)
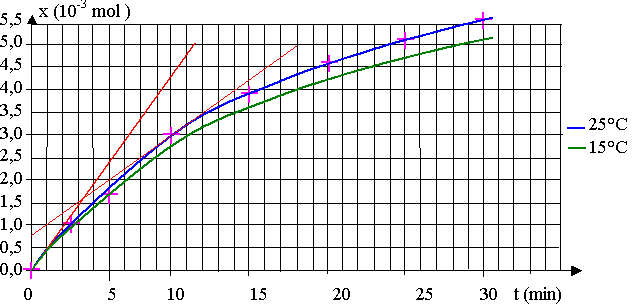
b) v0 = (1/V) . (dx/dt)0 = (1/ 0,200) . (5,0.10-3 – 0,0) /(11,5 – 0) = 2,2.10-3 mol.L-1.min-1
v10 = (1/V) . (dx/dt)10 = (1/ 0,200) . (5,0.10-3 – 0,7.10-3) /(18 – 0) = 1,2.10-3 mol.L-1.min-1
v0 = 3,6.10-5 mol.L-1.s-1 ; v10 = 2,0.10-5 mol.L-1.s-1
La vitesse de la réaction diminue car la concentration des réactifs diminue, ce qui ralentit la réaction, c'est un facteur cinétique.
ex 6 p 61 voir graphique précédent.
Quand la température diminue, la vitesse volumique de réaction diminue.
x augmente donc moins vite qu'à 25°C, la courbe est donc en dessous. xmax reste identique.
ex 7 p 61 a) n(H2) = V(H2) / Vm ; n(H2)50 = 36.10-3 / 25 = 1,4.10-3 mol
|
t (s) |
0 |
50 |
100 |
150 |
200 |
250 |
300 |
400 |
500 |
750 |
|
n(H2) 10-3 mol |
0,0 |
1,4 |
2,6 |
3,4 |
4,2 |
4,8 |
5,3 |
6,2 |
6,8 |
8,0 |
b) n(Zn)0 = 1,0 / 65,4 = 1,5.10-2 mol ; n(H+)0 = c . V = 0,50 x 40.10-3 = 2,0.10-2 mol
|
Equation chimique |
Zn(s) + 2 H+(aq) → Zn2+(aq) + H2 (g) |
||||
|
Etat du système |
Avancement |
Quantité de matière en 10-2 mol |
|||
|
Etat initial |
0 |
1,5 |
2,0 |
0,0 |
0,0 |
|
En cours de transformation |
x |
1,5 – x |
2,0 – 2x |
x |
x |
|
Etat final |
xmax |
1,5 - xmax |
2,0 – 2 xmax |
xmax |
xmax |
D'après le tableau, n(H2) = x
c)
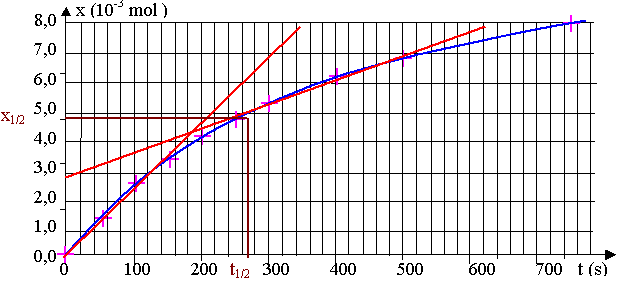
d) v50 = (1/V).(dx/dt)50 = (1 / 40.10-3) x (8,0.10-3 / 340) = 5,9.10-4 mol.L-1.s-1
v400 = (1/V).(dx/dt)400 = (1 / 40.10-3) x ((8,0 – 3,0).10-3 / 620 ) = 2,0.10-4 mol.L-1.s-1
e) Si Zn est limitant, n(Zn)f = 0 = 1,5.10-2 – xmax ; xmax = 1,5.10-2 mol
Si H+ est limitant, n(H+)f = 0 = 2,0.10-2 – 2 xmax ; xmax = 1,0.10-2 mol
La plus petite valeur correspond au xmax soit 1,0.10-2 mol, H+ est le réactif limitant.
x1/2 = xmax / 2 = 5,0.10-3 mol ; d'après le graphique , t1/2 = 275 s.
ex 9 p 62 :
Dismutation de l'ion thiosulfate S2O32-(aq) :
on mélange : V1 = 10 mL = 0,010 L de solution
( H+ , Cl- ) à c1 = 5,0 mol.L-1 avec
V2 = 40 mL = 0,040 L de solution ( 2 Na+ , S2O32-
) à c2 = 0,50 mol.L-1 V = V1+V2=
0,050 L
Equation : S2O32-(aq)
+ 2 H+(aq) → S(s) + SO2(aq) + H2O(l)
a)
[S2O32-]i
= c2.V2 / V = 0,50 x 0,040 / 0,050 = 0,40 mol.L-1
[ H+ ]i = c1.V1 / V = 5,0 x 0,010
/ 0,050 = 1,0 mol.L-1
b)
|
Equation chimique |
S2O32-(aq) + 2 H+(aq) → S(s) + SO2(aq) + H2O(l) |
|||||
|
Etat du système |
Avanc. |
Quantité de matière en mol |
||||
|
Etat initial |
0 |
[S2O32-]i.V |
[H+]i.V |
0 |
0 |
beaucoup |
|
En cours |
x |
[S2O32-]i.V - x |
[H+]i.V-2x |
x |
x |
beaucoup |
|
Etat final |
xmax |
[S2O32-]i.V-xmax |
[H+]i.V-2xmax |
xmax |
xmax |
beaucoup |
c) [S2O32-].V = [S2O32-]i.V-x ⇒ x = ([S2O32-]i - [S2O32-]).V.
|
t en s |
0 |
15 |
30 |
45 |
60 |
90 |
120 |
180 |
240 |
300 |
|
[S2O32-] |
0,400 |
0,330 |
0,260 |
0,200 |
0,167 |
0,110 |
0,066 |
0,028 |
0,017 |
0,014 |
|
x / V |
0,00 |
0,070 |
0,140 |
0,200 |
0,230 |
0,290 |
0,330 |
0,370 |
0,383 |
0,386 |
|
x en mmol |
0,00 |
3,50 |
7,00 |
10,0 |
11,5 |
14,5 |
16,5 |
18,5 |
19,1 |
19,3 |
d)
n(S2O32-
)i = [S2O32-]i . V
= 0,40 x 0,050 = 0,020 mol
n(H+ )i = [ H+ ]i .V = = 1,0 x
0,050 = 0,050 mol.L-1
Si S2O32- est limitant, [S2O32-]i.V-xmax
= 0 ⇒ xmax = [S2O32-]i.V
= 0,020 mol
Si H+ est limitant , [H+]i.V-2xmax
= 0 ⇒ xmax
= [H+]i.V / 2 = 0,025 mol
S2O32- est donc le réactif limitant et xmax
= 0,020 mol
e)
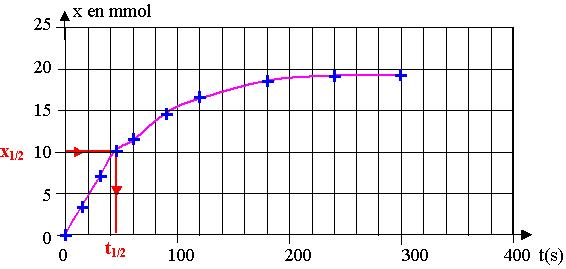
xmax / 2 = 0,010 mol =10 mmol . D'après le graphique, t1/2 = 45 s
ex 13 p 64
a) n0 = m / M = ρ x VRCl / M = 0,85 x 1000 x 1,0.10-3 / 92,6 = 9,210-3 mol
b) Tableau d'avancement :
|
Equation chimique |
RCl(l) + H2O(l) → H+(aq) + Cl-(aq) + ROH |
|||||
|
Etat du système |
Avanc. |
Quantité de matière en mol |
||||
|
Etat initial |
0 |
9,2.10-3 |
excès |
0 |
0 |
0 |
|
En cours |
x |
9,2.10-3 - x |
excès |
x |
x |
x |
|
Etat final t ∞ |
xmax |
9,2.10-3 -xmax |
excès |
xmax |
xmax |
xmax |
Le réactif limitant est RCl et xmax = 9,2.10-3 mol
c) Les espèces chimiques responsables de la conductivité σ sont les ions : H+ et Cl-
[H+] ∞ = [Cl-] ∞ = x / V σt = λ(H+) . [H+] + λ(Cl-) . [Cl-] = (λ(H+) + λ(Cl-)) . x / V
[H+] ∞ = [Cl-] ∞ = xmax / V = n0 / V σ ∞ = (λ(H+) + λ(Cl-)) . n0 / V
σt / σ ∞ = (x / V) / (n0 / V) = x / n0 x = n0 . σt / σ∞
d) x (40°C) (5min) = σ5 . n0 / σ ∞ = 4,9 x 9,2.10-3 / 8,4 = 5,35.10-3 mol = 5,35 mmol
|
t (min) |
0 |
1 |
2 |
5 |
10 |
15 |
20 |
|
x (mmol) à 40°C |
0 |
1,64 |
2,73 |
5,35 |
7,43 |
8,20 |
8,74 |
|
x (mmol) à 30°C |
0 |
0,97 |
1,81 |
3,74 |
5,92 |
7,13 |
8,21 |
σ ∞ (40°C) = 8,4 mS.cm-1 ; σ ∞ (30°C) = 7,6 mS.cm-1
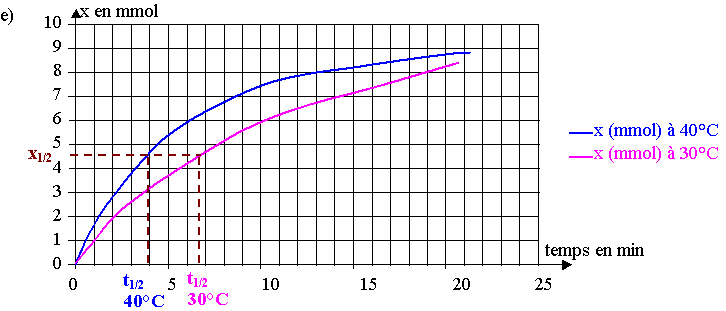
f) A 40°C, la transformation est plus rapide car la température est un facteur cinétique, l'avancement x au cours du temps est donc supérieur à celui à 30C.
La limite de l'avancement est la même et correspond à xmax = 9,2 mmol, ce qui se voit sur le graphique.
g) à t = t1/2 , x = xmax / 2 = 4,6 mmol.
D'après le graphique, à 40°C, t1/2 = 4,2 min = 4 min 12s et à 30°C, t1/2 = 6,9 min = 6 min 54s
©Sciences Mont Blanc