Exercices : Spécialité Chap 14 – Effectuer des contrôles de qualité
ex 4 p 197
1) Préparation de 0,500 L de solution de thiosulfate de sodium :
calcul de la masse de thiosulfate de sodium pentahydraté :
m = n.M = c1 . V1 . M(Na2S2O3,5H2O) = 5,0.10-3 x 0,500 x (2 x 23 + 2 x 32 + 3 x 16 + 5 x (2 x 1 + 16) = 0,62 g
On pèse cette masse , on verse le solide dans une fiole jaugée de 500 mL, on ajoute une moitié du volume en eau distillée et on dissout complètement le solide avant de compléter avec de l'eau distillée jusqu'au trait de jauge. On agite ensuite pour homogénéiser la solution.
2) Etalonnage de la solution :
a) réduction : I2 (aq)+ 2 e- = 2 I-(aq) et oxydation : 2 S2O32-(aq) = S4O62-(aq) + 2 e-
Les électrons mis en jeu sont en même nombre. On ajoute les 2 demi-équations : : I2 (aq)+ 2 S2O32-(aq) = S4O62-(aq) + 2 I-(aq)
b) Le diiode est jaune – brun mais lorsqu'il est dilué, il est difficile de voir sa couleur. On ajoute donc de l'empois d'amidon pour que son association avec le diiode donne une couleur bleu-noir bien visible.
c) A l'équivalence, on a : 2 n(I2)0 = n(S2O32-)versé Þ 2 c2.V2 = c1 . V1 éq
Þ c2 = c1 . V1 éq / 2V2 = 5,0.10-3 x 20,6.10-3 / (2 x 10,0.10-3 ) = 5,15.10-3 mol.L-1
3) Détermination de la masse d'acide ascorbique:
a) ) réduction : I2 (aq)+ 2 e- = 2 I-(aq) et oxydation : C6H8O6 = C6H6O6 + 2 e- + 2 H+(aq)
équation : : I2 (aq)+ C6H8O6 = C6H6O6 + 2 H+(aq) + 2 I-(aq) (2)
b) n(I2)0 = c2 . V2' = 5,15.10-3 x 20,0.10-3 = 1,03.10-4 mol
c) A l'équivalence, on a : 2 n(I2)excès = n(S2O32-)versé Þ n(I2)excès = c1 . V1 éq' / 2 = 5,0.10-3 x 17,8.10-3 / 2 = 4,45.10-5 mol
d) n(I2)réagi = n(I2)0 – n(I2)excès = 5,85.10-5 mol
e) D'après l'équation (2), on a : n(C6H8O6) = n(I2)réagi = 5,85.10-5 mol
f) m(vitamine C dans 1 L) =n(vitamine C dans 1 L) . M(vitamine C) = 5,85.10-5 x 50 x 176 = 0,515 g
g) Le résultat obtenu est proche de la masse de vitamine C dans un comprimé de "LAROSCORBINE 500"
ex 6 p 198
1) H3O+(aq) + HO-(aq) = 2 H2O(l)
On détermine le volume à l'équivalence, Véq par la méthode des tangentes : Véq = 10,2 mL
A l'équivalence, les réactifs ont été ajoutés dans les proportions stoechiométriques de l'équation : n(H3O+)0 = n(HO-)éq
c.V1 = cb.Véq Þ cb = c.V1 / Véq = 2,00.10-2 x 10,0 / 10,2 = 1,96.10-2 mol.L-1
2) On détermine le volume à l'équivalence, Véq' par la méthode des tangentes : Véq' = 14,3 mL
A l'équivalence, les réactifs ont été ajoutés dans les proportions stoechiométriques de l'équation : n(H3O+)0 = n(HO-)éq
c2.V2 = cb.Véq Þ c2 = cb .Véq / V2 = 1,96.10-2 x 14,3 / 20,0 = 1,40.10-2 mol.L-1
Soit nHA la quantité d'acide ascorbique présent dans un comprimé, nHA = c2.V car il est dissous dans ce volume.
nHA = 1,40.10-2 x 0,200 = 2,80.10-3 mol
mHA = nHA.MHA = 2,80.10-3 x 176 = 0,493 g = 493 mg » 500 mg
L'appellation "500" correspond à 500 mg d'acide ascorbique.
ex 7 p 199
Méthode de Charpentier-Vohlard
1) Une réaction de titrage doit être rapide , totale et unique.
2) La réaction (1) forme un précipité blanc de AgSCN mais rien n'est visible lorsque tous les ions Ag+ sont consommés.
3) a) Fe3+(aq) + SCN-(aq) = [Fe(SCN)]2+(aq)
b) Ag+(aq) + SCN-(aq) = Ag(SCN)(s)
Les ions SCN- réagissent préférentiellement avec les ions Ag+ et avec les ions Fe3+ lorsqu'il n'y a plus d'ions Ag+ .
c) Les 2 réactions en compétition sont celles décrites ci-dessus. Elles sont successives.
Les ions Fe3+ réagissent avec les ions SCN- lorsque tous les ions Ag+ ont été consommés, à l'équivalence du dosage des ions Ag+ et forment un complexe rouge bien visible. Cela permet de voir l'équivalence du dosage des ions Ag+ par les ions SCN- .
4) a) réactions en compétition : Ag+(aq) + Cl-(aq) = AgCl(s) et 2 Ag+(aq) + CrO42-(aq) = Ag2CrO4(s)
b) Ces réactions sont successives
c) Les ions CrO42- réagissent avec les ions Ag+ lorsque tous les ions Cl-(aq) ont été consommés, à l'équivalence du dosage des ions Cl- et forment un précipité rouge bien visible. Cela permet de voir l'équivalence du dosage des ions Cl- par les ions Ag+ .
ex 11 p 200
1) On utilise un grand bécher pour écarter suffisamment les électrodes. L'ajout de 150 mL d'eau distillée permet de diminuer les concentrations dans la solution et la conductivité de la solution.
2) Dans une eau minérale, il y a beaucoup d'ions, p 194 , on lit sur l'étiquette :
ions : Ca2+ , Mg2 , Na+, SO42- , NO3-, HCO3- . Cependant les ions sulfate sont majoritaires, on peut oublier la présence des autres ions dont la conductivité globale reste constante.
Les ions H3O+ et HO- sont présents en très faible quantité (pH » 7)
Ions importants présents avant l'équivalence : SO42- , Cl-
En ajoutant des ions Ba2+ et Cl- , des ions SO42- et Ba2+ sont consommés.
Pour la conductivité de la solution, des ions SO42- sont consommés et remplacés par des ions Cl- .
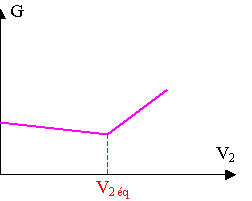 3) Ions importants
présents après l'équivalence : Ba2+, Cl- .
3) Ions importants
présents après l'équivalence : Ba2+, Cl- .
Après l'équivalence, les ions ajoutés ne sont plus consommés, la conductivité augmente donc vite
4) La courbe de la conductance forme une droite décroissante de faible pente avant l'équivalence et une autre croissante de pente importante après l'équivalence. L'équivalence se situe à l'intersection des 2 droites.
D'après le graphique, v2 éq = 15 mL
5) A l'équivalence, les réactifs ont été ajoutés dans les proportions stoechiométriques de l'équation :
n(SO42-)0 = n(Ba2+)éq = c2.V2 éq = 5,0.10-2 x 15.10-3 = 7,5.10-4 mol
Cette quantité d'ions sulfate était présente dans 50 mL d'eau minérale.
[SO42- ] = n / V = 7,5.10-4 / 50.10-3 = 1,5.10-2 mol.L-1
t(SO42-) = M(SO42-) . [SO42-] = (32 + 4 x 16) x 1,5.10-2 = 1,44 g.L-1 = 1440 mg.L-1
Ce résultat est cohérent avec l'indication de l'étiquette de l'eau d'Hépar p 194.
©Sciences Mont Blanc