TP Détermination colorimétrique du pKA
et
des domaines de prédominance d'un indicateur coloré : le B.B.T.
Objectifs :
Déterminer la zone de virage d'un indicateur coloré de pH et de mettre en évidence les domaines de prédominance des formes acide et basique de cet indicateur.
Mesurer expérimentalement le pKa du couple de cet indicateur.
I ) Principe de la méthode
Un indicateur coloré est un couple acide-base IndH/Ind- dont la forme acide, IndH, a une couleur différente de la forme basique, Ind-, en solution aqueuse. La prédominance de l'une de ces formes en solution est observable visuellement. Prenons le cas du bleu de bromothymol ou BBT. La forme basique Ind- est bleue et la forme acide IndH est jaune.
Les spectres d'absorption de ces deux espèces colorées sont figurés ci-dessous.
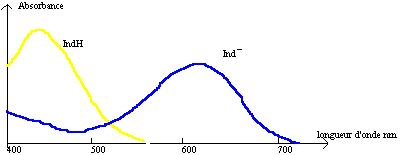
* Quelles sont les radiations principalement absorbées par la forme basique ? Situer la longueur d'onde du maximum d'absorbance. Conclure.
La forme basique ….. absorbe entre ….. et …… nm. lb max » …….nm
* Mêmes questions pour la forme acide.
La forme acide …… absorbe entre ….. et ….. nm. la max » ……. nm
* Existe-t-il une radiation lb fortement absorbée par la forme basique du BBT mais non absorbée par la forme acide ?
Si lb= 620 nm, la forme basique … est absorbée au ……… et la forme acide … …est ….absorbée.
* Partant d'une solution très acide de BBT, ne contenant que la forme acide HInd, ajouter progressivement une solution de soude de concentration 0,10 mol.L-1. Observer les changements de coloration et le virage de l'indicateur. Interpréter les changements survenus en faisant intervenir les quantités respectives des deux espèces données par la relation suivante en fonction du pH : pH = pKa + log [Ind-]/[IndH]
* On éclaire une solution contenant du BBT avec une radiation monochromatique de longueur d'onde lb, voisine de 620 nm. L'absorbance A de la solution à cette longueur d'onde obéit à la loi de ……………………des solutions colorées.
Exprimer A en fonction de [Ind-] en précisant les unités. A = …………..
Appelons c la concentration apportée de l'indicateur coloré, c'est à dire la concentration globale de l'indicateur sous ses deux formes.
En milieu très basique, pH voisin de 11, seule la forme …………. …….. de l'indicateur existe.
L'absorbance de cette solution basique à la longueur d'onde lb y est ………… car la concentration effective de l'espèce absorbante est elle-même ………... . On a : A =… = ………..
Si l'on travaille à volume constant et à concentration apportée
constante d'indicateur coloré, on pourra écrire, pour une valeur quelconque
du pH : A = …………. or Am/c =..…….
d'où : [Ind-]/c = ………
Exprimer le pourcentage de l'indicateur coloré sous sa forme basique. % In- = …….
Exprimer le pourcentage de l'indicateur coloré sous la forme acide . % InH =
II ) Manipulation et exploitation
Vous disposez d'une solution dite de BRITTON-ROBINSON (B.R) constituée d'un mélange de plusieurs acides et dont le pH varie régulièrement par addition de soude à 0,10 mol.L-1.
On peut admettre grossièrement que pour un volume initial de solution de B.R égal à 20 mL, le pH obéit à la loi simple : pH = 1,2 + V(soude), volume en mL.
Chaque groupe réalisera deux solutions dont les pH s'échelonneront entre 3,5 et 10,5 par pas de 0,5 unité de pH environ, soit en tout 16 solutions pour 8 groupes (les valeurs de pH seront rapprochées au voisinage de pH = 7).
Dans un bécher, placer 20,0 mL de solution de BRITTON-ROBINSON.
Ajouter le volume prévu de soude avec la burette en agitant. Vérifier si le pH convient sinon ajuster le en rajoutant de la solution de soude.
Prélever 20 mL du mélange obtenu avec une pipette jaugée et les placer dans un bécher où l'on inscrit un numéro puis y ajouter exactement 1,0 mL de solution de BBT avec une pipette jaugée .
Agiter à nouveau, mesurer le pH final avec un pH-mètre pour tous les groupes.
Mesurer l'absorbance de la solution au colorimètre ou au spectrophotomètre calé sur 620 nm.
Pour chaque solution, l'élève note, sur le tableau ci-dessous, le pH et l'absorbance de la solution .
Exploitation des résultats : Compléter le tableau :
|
pH |
|
|
|
|
|
|
|
|
|
Couleur |
|
|
|
|
|
|
|
|
|
Absorbance A |
|
|
|
|
|
|
|
|
|
% In- |
|
|
|
|
|
|
|
|
|
% InH |
|
|
|
|
|
|
|
|
|
pH |
|
|
|
|
|
|
|
|
|
Couleur |
|
|
|
|
|
|
|
|
|
Absorbance A |
|
|
|
|
|
|
|
|
|
% In- |
|
|
|
|
|
|
|
|
|
% InH |
|
|
|
|
|
|
|
|
Ø Tracer les courbes % In- = f (pH) et % InH = f (pH) en utilisant un tableur ou sur la feuille millimétrée avec les échelles : 1 cm = 10 % en ordonnées ; 1 cm = 1 unité de pH en abscisses.
Ø Indiquer les domaines de prédominance des formes acide et basique de l'indicateur.
Ø Estimer la zone de virage de cet indicateur coloré, d'abord grâce aux courbes, en estimant que 10 % de l'une des formes colorées suffisent à la distinguer dans le mélange, puis en disposant sur le bureau, côte à côte, et dans l'ordre des pH, les diverses solutions préparées.
Ø Déterminer sur les courbes la valeur du pKa du couple InH/In-.
Ø On peut utiliser les solutions de Britton-Robinson pour évaluer visuellement la zone de virage d'autres indicateurs colorés, hélianthine et phtaléïne.
©Sciences Mont Blanc
Fiche matériel
TP Détermination colorimétrique
du pKA et
des domaines de prédominance d'un indicateur coloré : le B.B.T
Elèves :
- Pipette jaugée de 20 mL et 1mL et pipeteur
- Six béchers et une burette graduée de 25 mL
- Solution de Britton-Robinson en flacon de 100 mL
- Eau distillée en pissette
- Solution de soude à 0,10 mol.L-1
- Solution de bleu de bromothymol
Bureau :
- Spectrophotomètre ou colorimètre et cuves
- pH-mètre et solutions tampon de pH 7,0 et 4,0
- Pipette automatique ou pipette jaugée de 1 mL
- Feutres à verre et étiquettes
- Deux portoirs de tubes
Préparation de la solution de Britton-Robinson
Dans une fiole de 1,00 L, mélanger 12,5 mL d'acide phosphorique à 1,00 mol.L-1, 12,5 mL d'acide éthanoïque à 1,00 mol.L-1 et 125 mL d'acide borique à 0,100 mol.L-1 (6,19 g.L-1) et compléter à 1L.