Correction Bac Polynésie Française Septembre 2002
Calculatrice autorisée
I ) Comportement d'une bonbine ( 3,5 points)
II ) Dosage d'une solution commerciale (4 points)
III ) Météosat, spot et les autres (5 points)
IV ) Vitamine A - Chimie de la vision (5 points)
Correction Bac Polynésie Française Septembre
2002 - I ) Comportement d'une bobine :
©Sciences Mont Blanc
Correction Bac Polynésie Française Septembre 2002 - II ) Dosage d'une solution commerciale :
I ) HBr(aq) + H2O(l) ® H3O+(aq) + Br –(aq)
II ) d = 1,47
%HBr = 46 % . Calcul pour V = 1 L ; mHBr
= %HBr x msolution
msolution = rsolution x V = d x reau x V = 1,47 x 1000 x 1 = 1470 g
mHBr = %HBr x msolution = 0,46 x 1470 = 676 g ; nHBr
= mHBr / MHBr = 676 / 81 = 8,35 mol
c = nHBr / V = 8,35 / 1 = 8,35 mol.L-1
III ) solution Na+ , HO- , cB = 0,10 mol.L-1
1) H3O+(aq) + HO-(aq) ® 2 H2O(l)
2) A l'équivalence, la quantité de matière de l'espèce à doser et la quantité de matière de l'espèce titrante ont été mélangées et ont réagi dans les proportions stoéchiométriques de l'équation.
3)
n(HO-(aq))E = n(A)0 ; cB.VBE0
= cA.VA ; VBE0 = cA.VA
/ VBE0 = 8,35 x 20 / 0,1 = 1670 mL
Ce volume est trop grand pour un dosage, la burette graduée ne contient au
plus que 25 mL .
IV ) On veut diluer par 100 : c' = c /100 Þ c' / c = 1 / 100 = V / V' ; V' = 100 V
D'après le matériel disponible, on ne peut utiliser qu'une fiole jaugée de 1000 mL et une pipette jaugée de 10 mL pour respecter le rapport 100.
Schéma de la manipulation:
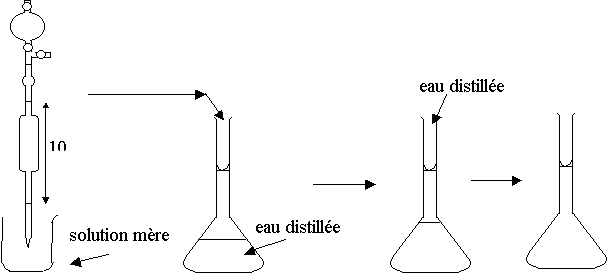
Lors de la dernière étape, on complète avec de l'eau distillée jusqu'au trait de jauge (le bas du ménisque formé par la surface de la solution doit affleuré le trait de jauge) et on agite pour homogénéiser la solution.
V ) 1) On dose un acide fort par une base forte, le pH à
l'équivalence vaut donc 7. La zone de virage de l'indicateur coloré doit contenir
pHE .
L'indicateur coloré adapté est donc le BBT, bleu de bromothymol.
2)
VBE1 = 16,7 mL , V'A = 20,0 mL ; cB.VBE1 = c'.VA ;
c' = cB.VBE1 / VA = 0,10 x 16,7.10-3
/ 20,0.10-3 = 0,0835 mol.L-1 ; c = 100 c' = 8,35 mol.L-1
Ce résultat est bien en accord avec la question 2.
3) VBE2 = 17,1 mL ; c' = 0,10 x 17,1.10-3/ 20,0.10-3 = 0,0855 mol.L-1 ; c = 100 c' = 8,55 mol.L-1
4)
Si V 'A exp < V 'A , c'exp
> c' . Ce qui peut correspondre
à l'erreur.
Si VBE2 exp < VBE2 , c'exp
< c' . Ce qui ne convient pas !
Seule l'erreur a) peut donc expliquer l'écart de valeur.
©Sciences Mont Blanc
Correction Bac Polynésie Française Septembre
2002 - III ) Météosat, spot et les autres :
©Sciences Mont Blanc
Correction Bac Polynésie Française
Septembre 2002 - IV ) Vitamine A :Chimie de la vision :
©Sciences Mont Blanc
