Correction Bac Pondichéry Avril 2002
Calculatrice autorisée
I ) L'eau de javel. Précaution d'emploi. Stabilité (4 points)
II ) Couple acide benzoïque/ion benzoate (5 points)
III ) Satellites de Jupiter (6 points)
IV ) Charge et décharge d'un condensateur (5 points)
III (spe) Le poste à galène (4 points)
Correction Bac Pondichéry Avril 2002 - I ) L'eau de
javel. Précaution d'emploi. Stabilité :
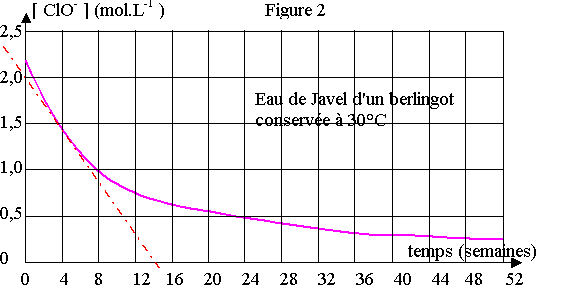
1 ) D'après la définition du degré chlorométrique, 48°chl. correspond à un volume de 48 L de gaz dichlore ( à Vm = 22,4 L.mol-1 ) pour 1 litre de solution.
n(ClO-) = V / Vm = 48 / 22,4 = 2,1 mol ; [ClO-] = n / V = 2,1 mol.L-1
2 ) vitesse instantanée de disparition de l’ion hypochlorite ClO- est la dérivée de [ClO-] par rapport au temps t : d[ClO-]/dt.
Elle correspond en un point d'un graphique à la pente de la tangente à la courbe.
On trace la tangente à la courbe à t = 4 semaines et on calcule le coefficient directeur a de cette droite.
a = ( 2,5 – 0 ) / ( 0 – 13 ) = - 0,19
La vitesse instantanée de disparition de l’ion hypochlorite ClO- vaut – 0,19 mol.L-1.sem-1 à la date t = 4 semaines .
3 ) a) On constate en comparant les courbes entre elles que plus la température est grande, plus la vitesse de la réaction (2) est grande.
La température est un facteur cinétique. Cela accélère la réaction.
On constate une courbe à la fois que la vitesse de la réaction diminue au cours du temps ( la pente de la tangente à la courbe diminue). Cela met en évidence le facteur cinétique de la concentration des réactifs, plus elle diminue, plus la vitesse de la réaction diminue.
b) La recommandation « conserver au frais » est justifiée car plus la température est basse plus la réaction (2) est lente et plus le degré chlorométrique se conserve mieux dans le temps.
c) Les flacons d'eau de javel étant beaucoup moins concentré, la réaction (1) est moins rapide car c'est un facteur cinétique. Ils se conservent donc mieux et ne nécessitent pas de délai d’utilisation
4 ) La réaction (3) qui se réalise en milieu acide , montre la formation de gaz dichlore, qui est
un gaz toxique.
5 ) Dans l'énoncé, on indique que les réactions des ions hypochlorites sont sensibles aux rayonnements UV, cela accélère les réactions. Il faut donc les éviter.L’eau de Javel est donc commercialisée dans des récipients opaques.
Annexe
1 à rendre avec la copie
©Sciences Mont Blanc
Correction Bac Pondichéry Avril 2002 -
II ) Couple acide benzoïque/ion benzoate :
1ère partie
1) C6H5-COOH(aq) + H2O(l) = C6H5-COO-(aq) + H3O+(aq)
2) KA = [C6H5-COO-].[H3O+] / [C6H5-COOH] ;
-log KA = - log [C6H5-COO-] / [C6H5-COOH] - log [H3O+]
pKA + log [C6H5-COO-] / [C6H5-COOH] = pH
Si pH > pKA , [C6H5-COO-] > [C6H5-COOH] , C6H5-COO- est prépondérant.
Si pH < pKA , [C6H5-COO-] < [C6H5-COOH] , C6H5-COOH est prépondérant.
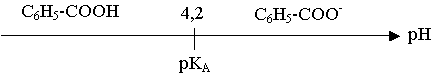
3) log [C6H5-COO-] / [C6H5-COOH] = pH – pKA = 3,5 – 4,2 = 0,70
[C6H5-COOH] / [C6H5-COO-] = 100,70 = 5,0
2ième partie
1) On veut diluer, on a donc : C.V = C0.V0 Þ V = (C0/C) V0 = 2,5 V0
On peut donc préparer 50 mL de solution avec 20 mL de solution mère.
On prélève la solution mère avec une pipette jaugée de 20 mL que l'on verse dans une fiole jaugée de 50 mL, puis on complète avec de l'eau distillée jusqu'au trait de jauge.
Enfin, on agite pour homogénéiser la solution.
2) A 10 mL de la solution S on ajoute un peu d’acide chlorhydrique concentré.
On note l’apparition d’un précipité blanc.
a) C6H5-COO-(aq) + H3O+(aq) = C6H5-COOH(aq) + H2O(l)
K = [C6H5-COOH]/([C6H5-COO-].[H3O+]) = ([C6H5-COOH].[HO-]/[C6H5-COO-])/([HO-]. [H3O+])
K = 1 / KA = 10 4,2 = 1,6.104
K > 104, on peut donc considérer la réaction comme totale.
b) Le précipité est de l'acide benzoïque.
n(C6H5-COOH)formé = n(C6H5-COO-)0 = C.V1
= 0,200 x 10.10-3 = 2,0.10-3 mol
m(C6H5-COOH) = n.M = 2,0.10-3 x 122 = 0,24 g ;
soit 24 g pour 1 litre.
La solubilité s1 est donc largement atteinte, par conséquent, l'excédent d'acide benzoïque se cristallise.
3ième partie
 1) Des « grains en suspension » reste dans le mélange préparé avant
sa filtration car la quantité d'acide benzoïque ajoutée dépasse la solubilité
de celui-ci, une partie ne peut pas se solubiliser.
1) Des « grains en suspension » reste dans le mélange préparé avant
sa filtration car la quantité d'acide benzoïque ajoutée dépasse la solubilité
de celui-ci, une partie ne peut pas se solubiliser.
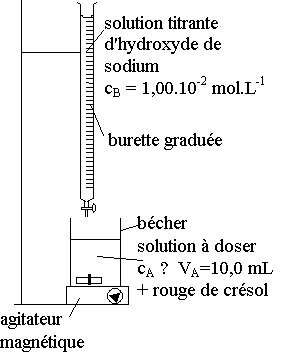
2) schéma du dosage :
3) La solution de départ est acide, elle est donc jaune (couleur du rouge de crésol à pH acide)
A l'équivalence, les réactifs ont été complètement consommés, la solution contient alors de l'eau et des ions benzoate, elle est donc basique et de couleur rouge.
Le changement de couleur observé est donc du jaune au rouge.
4) C6H5-COOH(aq) + HO-(aq) = C6H5-COO-(aq) + H2O(l)
5) A l'équivalence, les réactifs ont été complètement consommés, on a donc :
n(C6H5-COOH)0 = n(HO-)eq Þ CA.VA = CB.Veq
Þ CA = CB.Véq / VA = 1,00.10-2 x 19,6.10-3 / 10,0.10-3 = 1,96.10-2 mol.L-1
6) s = CA . M = 1,96.10-2 x 122 = 2,39 g.L-1
.
©Sciences Mont Blanc
Correction Bac Pondichéry Avril 2002 - III ) Satellites
de Jupiter :
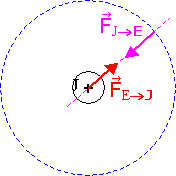
I.1) FJ®E = G.ME.MJ / d2
2) a) Un mouvement uniforme se fait à une vitesse constante.
b) Un référentiel « jupitocentrique » est constitué du centre de Jupiter et de trois étoiles lointaines considérées comme fixes .
Dans ce référentiel supposé galiléen, on applique la deuxième loi de Newton au satellite Europe : ME. a = FJ®E (1)
On utilise le repère de Frenet : soit u vecteur unitaire normal à la trajectoire et v vecteur unitaire tangent à la trajectoire.
a = aN + aT = aN.u + aT.v ; aN = v2 / d et aT = dv/dt
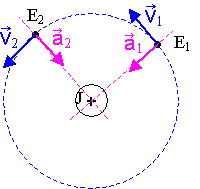 FJ®E = FJ®E .u . D'après
la relation (1) , on a :
FJ®E = FJ®E .u . D'après
la relation (1) , on a :
ME.v2 / d = G.ME.MJ / d2 (2) et m.dv/dt = 0 (3)
On a donc dv/dt = 0, la vitesse est donc constante, le mouvement est uniforme.
c) Les vecteurs vitesses V1 et V2 ont même norme, v1 = v2 mais leur direction est différente, tangente à la trajectoire.
D'après la relation (1), a1 = a2 = FJ®E /m .
Elles ont donc même norme mais des directions différentes.
II ) 1) D'après la relation (2) , on a : ME.v2 / r = G.ME.MJ / r2 Þ v2 = G.MJ / r
2) En une période T de révolution, le satellite parcourt une distance D égale au périmètre du cercle de trajectoire.
D = 2 p r et v = D / T
v2 = (2 p r)2 / T2
= G.MJ / r Þ 4 p2
r3 / (G.MJ) = T2 Þ T = 2p ![]() (r3/G.MJ)
(r3/G.MJ)
3) a) D'après ce qui précède : T2 / r3 = 4 p2 /(G.MJ)
D'après cette relation, on constate que le rapport T2 / r3 ne dépend que de MJ., il est donc identique pour les 4 satellites.
b) La période de révolution de Io autour de Jupiter est TIo = 1 j 18 h 18 min.
Thébé autre satellite de Jupiter possède une orbite de rayon moitié de celui de l’orbite de Io.
rTh / rIo = 1/2 , TIo2 / rIo3 = TTh2 / rTh3
Þ TTh
= TIo . ![]() (rTh3/rIo3)
= ( 1 x 24 x 60 + 18 x 60 + 18 ) x
(rTh3/rIo3)
= ( 1 x 24 x 60 + 18 x 60 + 18 ) x ![]() (1/23)
= 897 min = 14 h 57 min
(1/23)
= 897 min = 14 h 57 min
4) Europe n'est pas « jupitostationnaire » car sa période est différente de la période de révolution de Jupiter sur elle-même.
©Sciences Mont Blanc
Correction Bac Pondichéry Avril 2002 -
IV ) Charge et décharge d'un condensateur :
I ) 1) Le phénomène physique mis en jeu quand on place l'interrupteur
K en position (1) est la charge du condensateur. Il est très rapide car la
constante de temps t
est très petite et la charge complète se fait en un temps proche de 5 t. C
voisin de 60.10-6 ; t voisin de 10 x 60.10-6= 6.10-4 s.
La charge se fait presque en 3 ms.
2) a) Le phénomène physique mis en évidence est la décharge du condensateur.
b) On trace la tangente à l'origine qui coupe l'asymptote ( u = 0 V ) au temps t = t .
c) t = 0,0005 s.
C = t/
R=0,0005/ 10= 5.10-5 F = 50 mF
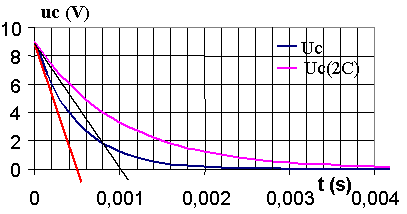
d) Pour tracer cette courbe, on trace la nouvelle tangente à l'origine passant par t ( 0,001 s )
II ) 1) a) En voie Y1 , on visualise la tension
du condensateur.
En voie Y2 , on visualise la tension du conducteur ohmique (résistance)
b) La tension du conducteur ohmique uR permet de connaître les
variations de l'intensité i du courant car i = uR / R. Les variations
sont les mêmes à une constante près.
2) a) La courbe x correspond à la tension du condensateur,
elle est maximale au début, le condensateur est chargé. La courbe y correspond
à la tension du conducteur ohmique, elle est nulle au début, le courant est
nul à cet instant.
Le phénomène observé est la décharge du condensateur avec oscillations libres
amorties.
b) Cela ne se produit pas dans l'expérience du I ) car il n'y a pas de bobine, c'est elle qui est responsable des oscillations dans le 2ème circuit.
III ) 1) EM = ½ L.i2 et EE = ½ C.u2
2) a) La courbe (5) correspond à la somme EE+EM car elle est toujours la plus grande et elle est la somme des courbes (3) et (4).
La courbe (3) correspond à EE car elle est maximum à t = 0 s.
La courbe (4) correspond à EM car elle est minimum à t = 0 s.
En observant les 2 courbes (3) et (4), on constate qu'elles varient en opposition de phase, lorsque l'une diminue , l'autre augmente et inversement. En fait, l'énergie du système LC oscille entre la bobine et le condensateur.
c) L'énergie totale E (EE+EM) diminue au cours du temps. Ceci s'explique par la présence du conducteur ohmique R', il y a des pertes par effet joule, par dissipation de chaleur.
A t = 0 s, E » 0,0025 J et au bout de 60 ms, E » 0,0005.
DE » 0,002 J en 60 ms.
©Sciences Mont Blanc
Correction Bac Pondichéry Avril 2002 -
III ) Le poste à galène (spécialité) :
©Sciences Mont Blanc
