Correction Bac France - Juin 2003
Calculatrice non autorisée
I ) Etude de la vitamine C (4 points)
I ) Etude d'un médicament (4 points) (spe)
II ) Charge d'un condensateur à l'aide d'une pile (7 points)
III ) Autour du radium (4 points)
Correction France - Juin 2003 - I ) Etude de la vitamine C
I ) Etude de la réaction entre une solution aqueuse d'acide ascorbique et une solution aqueuse d'hydroxyde de sodium :
acide ascorbique : HA , CA=1,00 10-2 mol.L-1 et soude CB=2,00 10-2mol.L-1 ; VA = 20,0 mL et
1) équation : HA(aq) + HO-(aq)
= A-(aq) + H2O(l)
2) VB = 5,0 mL a) pH =
4,0. [H3O+]éq
= 10-pH = 10-4,0 mol.L-1
b) [HO-]éq = Ke / [H3O+]éq
= 10-14 + 4,0 = 10-10 mol.L-1
nf(HO-) = [HO-]éq
x V = 10-10 x 25.10-3= 2,5.10-12 mol
c)
|
Equation de la réaction |
HA(aq) + HO- (aq) = A-(aq) + H2O(l) |
||||
|
Etat du système |
Avancement |
Quantité de matière en mol |
|||
|
Etat initial |
0 |
n0(HA)=CA.VA |
CB.VB |
0 |
0 |
|
Etat final |
xf |
nf(HA)= CA.VA -xf |
CB.VB -xf |
xf |
xf |
CA.VA = 1,00.10-2 x 20,0.10-3 = 2,00.10-4 mol ; CB.VB = 2,00.10-2 x 5,0.10-3 = 1,0.10-4 mol
nf(HO-) = CB.VB -xf = 2,5.10-12 mol ; xf » 1,0.10-4 mol
 d)
Si la réaction est totale , CB.VB -xmax =
0 ( HO- est en défaut ) ; xmax = CB.VB
= 1,0.10-4 mol
d)
Si la réaction est totale , CB.VB -xmax =
0 ( HO- est en défaut ) ; xmax = CB.VB
= 1,0.10-4 mol
t = xf / xmax = 1. La réaction est totale. Cette réaction est rapide, totale et unique, elle peut donc servir de support pour doser une solution aqueuse d'acide ascorbique par une solution de soude.
II ) Dosage colorimétrique d'un comprimé de vitamine C :
Un comprimé de "vitamine C 500" dans une
fiole jaugée de 100,0 mL avec l'eau distillée
( S ). VA=10,0mL
de S dosé avec une solution de soude
CB=2,00.10-2 mol.L-1.VBE=14,4mL
1) schéma annoté du titrage.
2) D'après la courbe de titrage sur la figure de l'annexe,
pHE vaut près de 8, l'indicateur coloré le mieux adapté est donc
le rouge de crésol dont la zone de virage comprend pHE
3) A l'équivalence, les réactifs ont été ajoutés dans les proportions stœchiométriques. n(HA)0 = n(HO- )versé à l'équivalence
4) n(HA)0 = CB.VBE = 2,00.10-2 x 14,4.10-3 = 2,88.10-4 mol
5) La quantité n(HA)0 correspond à VA=10,0
mL de solution S
Dans la fiole de 100,0 mL, il y a 10 fois plus de HA. n(HA)comprimé
= 10 n(HA)0 = 2,88.10-3 mol
M(C6H8O6)
= 6 x 12,0 + 8 x 1,0 + 6 x 16,0 = 176 g.mol-1 .
m = n x M = 2,88.10-3 x 176 = 0,507 g = 507 mg
L'indication du fabricant "vitamine C 500" correspond en fait à la masse d'acide ascorbique dans un comprimé. la différence est due aux erreurs d'expérience ou de fabrication.
Annexe: à rendre avec la copie

III ) Etude de la molécule d'acide ascorbique :
Le groupe fonctionnel (1) correspond à la famille des esters.
Le groupe fonctionnel (2) correspond à la famille des alcools
©Sciences Mont Blanc
Correction France - Juin 2003 - I ) Etude d'un médicament (spe)
1) Fe3+(aq) + e- = Fe2+(aq)
2.1) Il faut une burette de 25,0 mL pour prélever S, une pipette jaugée de 2,00 mL pour la solution d'o-phénanthroline, une pipette jaugée de 1,00 mL pour la solution d'hydroquinone, une fiole jaugée de 50,0 mL
2.2) Dilution : mavant = maprès ; t1.V1 = t .V ; tl = t .V/ V1 = 20,0 x 25,0/50,0 = 10,0 mg.L-1
2.3) Il faut que tous les ions Fe2+ réagissent avec l'o-phénanthroline pour chercher la relation entre l'absorbance A et la concentration en ions fer (II).
2.4) Le coefficient directeur est k = 1,80 / 10,0.10-3 = 180 L.mg-1 ; A = 180 x t avec t en g.L-1
3.1) Le colorant est de couleur rose, couleur voisine de celle de la solution contenant des ions Fe2+(aq) et l'o-phénanthroline. Ce colorant absorbe sans doute autour de 500nm et peut donc perturber les mesures.
3.2) t'0 = A / 180 = 1,35 / 180 = 0,00750 g.L-1 =7,50 mg.L-1
t0 = t'0 .V'0 / V0 = 7,50 x 50,0/5,00 = 75,0 mg.L-1
3.3) La masse du fer dans un comprimé est de 75 mg car on a dissous un comprimé dans 1L d'eau L'écart relatif est 80-75 / 80 = 6,25 %.
3.4) n(Fe2+) = 256,30.10-3 / (55,8 + 32,1 + 4 * 16+ x.18 )= 256,30.10-3 / (151,9 + 18 x)
n(Fe2+) = 80.10-3 / 55,8 Þ 256,30.10-3 * 55,8 / 80.10-3 = 151,9 + 18 x ; x = 1,49 » 1,5
©Sciences Mont Blanc
Correction France - Juin 2003 - II ) Charge d'un condensateur à l'aide d'une pile :
1 ) Réalisation d'une pile :
1.1) Schéma
1.2) Qr , i = [Zn 2+]i / [Cu2+]i
= C1 / C2 = 1,0 / 1,0 = 1
Qr ,i < K Þ Le système évolue dans le sens direct de l'équation : Cu2+(aq) + Zn(s) = Cu(s) + Zn 2+(aq)
1.3) A l'électrode de cuivre : Cu2+(aq) + 2 e- = Cu(s)
A l'électrode de zinc : Zn(s) = Zn 2+ (aq) + 2 e-
1.4) L'électrode de zinc donne des électrons au circuit, c'est donc le pôle - ; l'électrode de cuivre reçoit les électrons, c'est donc le pôle Å
1.5) D'après le sens de la réaction, les réactifs sont le métal zinc et les ions Cu2+ , le métal zinc est en excès, les ions Cu2+ sont donc en défaut.
n(Cu2+)0 = C2 x V2 = 1,0 x 0,1 = 0,1 mol. n(Cu2+)f = n(Cu2+)0 – xf = 0 , xf = n(Cu2+)0 =0, 1 mol
D'après la demi-équation, n(e- ) = 2 n(Cu2+)0 = 0,2 mol.
Quantité max d'électricité : Qmax = n(e-).F = n(e-).NA.e = 0,2 x 6,02.1023 x 1,6.10-19 = 1,93.104 C
2.1 Lorsque le condensateur est chargé complètement, les électrons ne circulent plus , il n'y a plus
de courant dans le circuit : i = 0 A. La valeur de E correspond à la valeur de uC lorsque le
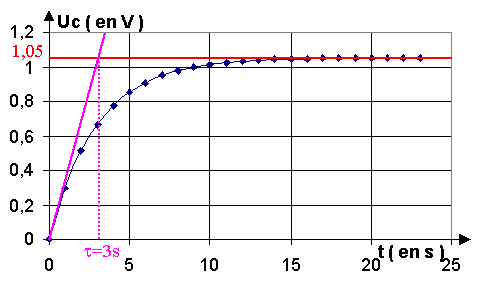
condensateur est chargé , lorsque l'intensité i est nulle: E = 1,05 V
2.2.1. t = r
. C où r est la résistance interne
de la pile et C la capacité du condensateur.
[t]
= [r].[C] , ur = r.i Þ [r] = U / I ;
q = C.uC = I.t Þ
[C] = I.T/ U
[t]
= ( U / I ).(I.T / U) = T Þ t a bien la dimension d'un temps
2.2.2. On trace la tangente à l'origine
, elle coupe l'asymptote à la courbe au temps t. t = 3 s
2.2.3. r = t / C = 3 / 330.10-6 = 9
090 W
2.3.1. i = dq / dt
2.3.2. q = C.uC
2.3.3. D'après le montage, la loi
des tensions indique : uPN = uC Þ
E – r.i = uC Þ E = uC + r.i
i = dq / dt = C.duC / dt Þ E = uC + r.C.duC/dt (1)
2.3.4. uC(t) = E.( 1 – e- a.t) ; duC
/ dt = a.E.e - a.t ; (1) E = E.( 1 – e - a.t ) + r.C.a.E.e - a.t
0 = ( r.C.a – 1
).E.e -a.t
; pour que ceci soit valable quelquesoit
l'instant t, il faut que :
r.C.a
- 1 = 0 Þ
a
= 1 / (R.C)
ANNEXE – FIGURE 3
©Sciences Mont Blanc
Correction France - Juin 2003 - III ) Autour du radium
1. Affirmation fausse. 84 désigne Z le nombre de protons et 208 désigne A le nombre de nucléons.
Il y a donc 84 protons et 124 neutrons.
2. Affirmation fausse. Il existe un défaut de masse Dm entre la masse des nucléons et celle du noyau : Dm = m(nucléons) – m(noyau)
3. Affirmation exacte. La particule a est bien un noyau ![]() . L'équation
vérifie bien les lois de conservation de Soddy, conservation du nombre de
protons et du nombre de nucléons.
. L'équation
vérifie bien les lois de conservation de Soddy, conservation du nombre de
protons et du nombre de nucléons.
4. Affirmation fausse. Des isotopes ont le même nombre de protons Z et un nombre de neutrons différents. Or ici, Z est différent pour ces noyaux.
5. Affirmation fausse. L'équation de désintégration b- est : ![]() ®
®![]() +
+ ![]()
6. Affirmation vraie. t ½ = 3,8 jours ; t = 3 x t ½ = 11,4 jours
N = N0.e – ln2 . t / t ½ ; N / N0 = 2 -t / t ½ = 1/ 23 = 1 / 8 = 12,5 %
7. Affirmation fausse. Une désintégration a diminue le nombre de nucléons de 4 ; une désintégration b- ne modifie pas le nombre de nucléons.
Pour passer de ![]() à
à
![]() , il faut diminuer le
nombre de nucléons de 12, ce qui correspond à 3 désintégrations a et non 2.
, il faut diminuer le
nombre de nucléons de 12, ce qui correspond à 3 désintégrations a et non 2.
8. Affirmation fausse. A = 6,0.105 Bq . 1
bq = 1 désintégration par seconde.
A = 6,0.105 x 60 = 3,6.107 désintégrations par minute.
9. Affirmation
fausse. E = Dm.c2
= [m(![]() )
– (m(
)
– (m( ![]() )+m(
)+m(![]() ))].c2
))].c2
E = (3,752438.10-25 - 6,64465.10-27 - 3,685904.10-25
) x (2,998.108)2 = 7,864.10-13 J
E = 7,864.10-13 / 1,602.10-19 = 4,909.106 eV = 4,909 MeV
10. Affirmation vraie. A = 3,75.103 Bq pour Vgaz = 1
m3 ; l = 2,10.10-6 s-1
A = l.N ; N
= A / l
= 3,75.103 / 2,10.10-6 =1,79.109 noyaux =
1,79.109 / 6,02.1023 » 3.10-15 mol
©Sciences Mont Blanc