Correction Bac Polynésie Septembre 2003
I ) Autour d'une transformation dans le domaine de l'oxydo-réduction (9,5 points)
II ) Le condensateur dans tous ses états (2,5 points)
III ) Etude d'un texte sur les ondes (4 points)
III ) Dosage de l'étain dans le fer blanc (4 points)
Correction Polynésie Septembre 2003 - I ) Autour d'une
transformation dans le domaine de l'oxydo-réduction :
A ) Etude d'une réaction d'oxydoréduction lorsque les deux réactifs sont directement en contact.
1) [Ag+]i = n1 / (V1 + V2 ) = C1.V1 / (V1 + V2 ) = 1,0.10-1 x 20.10-3 / 40.10-3 = 0,05 mol.L-1
[Cu2+]i = n2 / (V1 + V2 ) = C2.V2 / (V1 + V2 ) = 5,0.10-2 x 20.10-3 / 40.10-3 = 0,025 mol.L-1
2.1) Qr = [Cu2+] / [Ag+] 2
2.2) Qr, i = [Cu2+]i / [Ag+]i 2 = 0,025 / 0,05 2 = 10
2.3) On utilise le critère d'évolution. Qr, i < K, le système évolue dans le sens direct de l'équation.
2.4) Il y a formation d'ions Cu2+ bleus, la solution devrait donc se colorer en bleu.
2.5) K =[Cu2+]f
/ [Ag+]f 2; [Ag+]f
=![]() ([Cu2+]f
/ K).[Ag+]=
([Cu2+]f
/ K).[Ag+]=![]() (5,00.10-2/ 2,2.1015)=4,77.10-9mol.L-1
(5,00.10-2/ 2,2.1015)=4,77.10-9mol.L-1
Cette concentration est très faible. On peut donc conclure que la transformation est presque totale.
B ) Constitution et étude d'une pile :
 2.1) Le courant
circule de l'argent vers le cuivre, les électrons circulent en sens inverse
du cuivre vers l'argent dans le conducteur ohmique.
2.1) Le courant
circule de l'argent vers le cuivre, les électrons circulent en sens inverse
du cuivre vers l'argent dans le conducteur ohmique.
2.2) L'électrode de cuivre est donc la borne - , l'anode.
Il s'y produit l'oxydation du cuivre en ions Cu2+ :
Cu(s) = Cu2+(aq) + 2 e- .
L'électrode d'argent est la borne Å, la cathode.
Il s'y produit la réduction des ions Ag+ en métal argent : Ag+(aq) + e- = Ag(s)
2.3) Le sens de la réaction spontanée est en accord avec
celui déterminé dans la question A) 2.1)
Ce qui confirme qu'une pile est le lieu de réaction spontanée.
2.4) Le pont salin permet de fermer le circuit électrique, il assure le passage du courant entre les 2 solutions, sous forme d'un déplacement d'ions. Il permet aussi de conserver la neutralité des solutions en leur apportant des ions. D'un côté, il y a consommation d'ions Ag+ , le pont salin apporte des ions K+ pour compenser. Dans l'autre bécher, il y a formation d'ions Cu2+ , le pont salin apporte des ions NO3- pour neutraliser.
3.1) Tableau d'avancement :
n(Ag+)0=C1.V1=1,0.10-1x
20.10-3=2,0.10-3 mol ;
n(Cu2+ )0= C2.V2= 5,0.10-1
x 20.10-3= 1,0.10-2 mol
n(Cu)0 = m(Cu)0 / M(Cu) = 1,0 / 63,5 = 1,57.10-2 mol
D'après la valeur de la constant d'équilibre K, on peut considérer la réaction comme totale.
|
Equation chimique |
2 Ag+(aq) + Cu(s) ® 2 Ag(s) + Cu2+(aq) |
||||
|
Etat du système |
Avancement |
Quantité de matière en mol |
|||
|
Etat initial |
0 |
2,0.10-3 |
1,57.10-2 |
n(Ag)0 |
1,0.10-3 |
|
En cours |
x |
2,0.10-3 – 2x |
1,57.10-2 - x |
n(Ag)0 + 2 x |
1,0.10-3 + x |
|
Etat final |
xmax |
2,0.10-3-2xmax |
1,57.10-2-xmax |
n(Ag)0 +2 xmax |
1,0.10-3+xmax |
3.2) Si Ag+ est le réactif limitant, n(Ag+ )f = 0 = 2,0.10-3 - 2xmax Þ xmax = 1,0.10-3 mol
Si Cu est le réactif limitant, n(Cu)f = 0 = 1,57.10-2 - xmax Þ xmax = 1,57.10-2 mol
L'avancement maximal atteint le plus vite est 1,0.10-3 mol, Ag+ est le réactif limitant.
3.3) [Cu2+]f = n(Cu2+ )f / V2 = (1,0.10-3 + xmax ) / V2 = 2,0.10-3 / 20.10-3 = 0,10 mol.L-1
3.4) D'après la demi-équation : Ag+ + e- = Ag ; n(e- )max = n(Ag+ )cons = 2xmax = 2,0.10-3 mol
Q = n(e- ).F ; Qmax = 2,0.10-3 x 96,5.103 = 193 C
3.5) c = Qmax = 193 C = 193 / 3,6.103 = 0,0536 A.h
©Sciences Mont Blanc
Correction Polynésie Septembre 2003 - II
) Le condensateur dans tous ses états :
1ère partie
1.1) q = I . t ; q = 12.10-6 x 3,0 = 3,6.10-5 C

1.2) q = C . uAB
D'après le graphe n°1, la courbe est une droite.
C est donc le coefficient directeur de la droite. On trace la droite passant par l'origine et passant au plus près des points et on calcule son coefficient directeur :
C = (q(10) – q(0)) / (10 – 0) = 47.10-6 /10
C = 4,7.10-6 F = 4,7 mF
1.3) La valeur obtenue correspond exactement à celle indiquée par le constructeur.
2ème partie
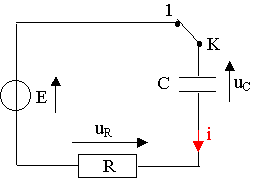 2.1) Loi des tensions dans le circuit
: E = uR + uC
2.1) Loi des tensions dans le circuit
: E = uR + uC
q = C.uC ; i = dq/dt = C.duC/dt ; uR = R.i
E = R.C.duC/dt + uC
2.2) uC = A.(1 – e - a.t ) ; duC/dt = a.A.e - a.t
E = A.(1 – e - a.t ) + R.C.a.A.e - a.t
E = A + A.(R.C.a - 1).e - a.t
Pour que cette relation soit valable, il faut que :
E = A et A.(R.C.a - 1 ) = 0 Þ a = 1 / (R.C)
2.3) uC = E.(1 – e –t / R.C )
Si t est grand, uC tend vers E. D'après le graphe n°2, uC tend vers 5 V. E = 5 V
2.4) uC(t + Dt) = uC(t) + (duC/dt)t . Dt . Dt = 1 ms.
a) E = R.C.duC/dt + uC à t = 0 s , uC(0) = 0 V ;
(duC/dt)0 = E / (R.C) = 5 / (2,2.103 x 4,7.10-6 ) = 484 V.s-1
b)
|
t ( ms ) |
0 |
1 |
2 |
3 |
|
uC (t) (…) |
0 |
0,484 |
0,921 |
1,32 |
|
duC/dt (…) |
484 |
437 |
394 |
356 |
uC 1 = uC 0 + (duC/dt)0.Dt = 0 + 484 x 1.10-3 = 0,484 V
(duC/dt)1 = (E – uC 1) / (R.C) = (5 – 0,484) / (2,2.103 x 4,7.10-6 ) = 437 V.s-1
uC 2 = uC 1 + (duC/dt)1.Dt = 0,484 + 437 x 1.10-3 = 0,921 V
(duC/dt)2 = (E – uC 2) / (R.C) = (5 – 0,921) / (2,2.103 x 4,7.10-6 ) = 394 V.s-1
uC 3 = uC 2 + (duC/dt)2.Dt = 0,921 + 394 x 1.10-3 = 1,32 V
(duC/dt)3 = (E – uC 2) / (R.C) = (5 – 1,32) / (2,2.103 x 4,7.10-6 ) = 356 V.s-1
2.5) a) Plus le pas Dt choisi est petit, plus la courbe obtenue se rapproche de la courbe réelle, plus la méthode est précise.
b) L'avantage d'avoir un pas grand est que la méthode est plus rapide, il y a moins de calcul mais la méthode est moins précise; A l'inverse, en utilisant un pas petit, la méthode est précise mais les nombreux calculs la rendre plus longue.
c) Dans le cas étudié, le condensateur se charge complètement en 0,04 s environ.
Il faut donc que le pas choisi soit petit par rapport à ce temps de charge.
2.6) La constante de temps t est le temps au bout duquel le condensateur est chargé à 63 %

uC(t) = 0,63 E = 0,63 x 5 = 3,15 V
D'après le graphique, t vaut 0,0105 s.
t = R.C Þ C = t / R = 0,0105 / 2,2.103 = 4,77.10-6 F
Cette valeur est proche de la valeur nominale ( 1,5 % de différence )
2.7) a) La constante de temps donne un ordre de grandeur de la durée de charge ou de décharge.
t = R.C » 0,01 s et t' = R'.C = 10.103 x 4,7.10-6 = 0,047 s
La durée de la décharge du condensateur est supérieure à celle de la charge.
b) L'affirmation est fausse, t' = R'.C. La résistance R n'est pas dans le circuit de décharge.
©Sciences Mont Blanc
Correction Polynésie Septembre 2003 - III ) Etude d'un
texte sur les ondes :
I ) Questions sur le texte :
1) ½ h1 = 2000 m, l1 < ½ h1 , la houle est donc classée en ondes courtes.
v1 = ![]() (g.l1/2p) =
(g.l1/2p) = ![]() ( 10 x 80 / (2 x 3,14)
= 11,3 m.s-1 , soit environ 11 m.s-1
( 10 x 80 / (2 x 3,14)
= 11,3 m.s-1 , soit environ 11 m.s-1
v1 = l1 / T , T = l1 / v1 = 80 / 11,3 = 7,1 s
2) h2
= 3 m , v2 = ![]() (g.h2)
=
(g.h2)
= ![]() (10
x 3) = 5,5 m.s-1 , l2 = v2 . T = 5,5 x 7,1 » 39 m
(10
x 3) = 5,5 m.s-1 , l2 = v2 . T = 5,5 x 7,1 » 39 m
3) La largeur (30m) de l'obstacle étant de l'ordre de grandeur de l2 , il se produit une diffraction.
On peut observer des vagues en arc de cercle.

La longueur d'onde l est la même avant et après la digue.
Les ondes lumineuses (non mécaniques) subissent aussi ce phénomène de diffraction.
II ) 1)a) La courbe est une droite affine d'équation x = a.t + b x est donc proportionnel à t.

La vitesse est donc constante et égale au coefficient directeur a de cette droite :
a = v = (x(0,4) – x(0,2))/(0,4 – 0,2) = (0,147 – 0,098) / 0,200 = 0,245 m.s-1
b) La ride n°1 et la ride n°4 sont espacées de 3 l. l = d / 3 = 0,088 / 3 = 0,029 m
v = l.f ; f = v / l = 0,245 / 0,029 = 8,4 Hz.
Les valeurs calculées de v et l sont donc en accord avec f donnée par le stroboscope.
 2) a) v = d' / t . D'après le document D, d'
= 2,5 l . t = d'
/ v = 2,5 l
/ v = 2,5 T
2) a) v = d' / t . D'après le document D, d'
= 2,5 l . t = d'
/ v = 2,5 l
/ v = 2,5 T
b) Le point M étant le front de l'onde, il avance, il se
déplace horizontalement vers la droite .
Cependant l'énoncé laisse plané un doute, on peut aussi considérer que le point M serait à une abcisse x fixe et dans ce cas, à l'instant d'après, il subit l'onde et se déplace verticalement vers le haut.
3) v' est supérieure à v. Cette différence est due au phénomène de dispersion, la célérité dépend de la fréquence.
Les ondes lumineuses présentent aussi ce phénomène.
La décomposition de la lumière par un prisme est une application de ce phénomène.
©Sciences Mont Blanc
Correction Polynésie Septembre 2003 -
III ) Dosage de l'étain dans le fer blanc (spe) :
I ) Electrolyse :
1) L'oxydation se
fait à l'anode, qui est ici la plaque de fer blanc. Elle fournit des électrons
au circuit, qui arrivent à la borne P2 , le courant circule dans
l'autre sens. La borne P2 est la borne positive de l'alimentation.
2) On arrête l'électrolyse
dès l'apparition de la coloration rouge car cela indique la formation d'ions
Fe2+ , l'oxydation du métal fer, le métal Sn a été complètement
consommé.
3) D'après la demi-équation,
nSn consommé = nSn2+formé .
La coloration rouge
apparue indique que tout le métal Sn a été consommé.
On a donc : nSn2+ = nSn
II ) Dosage indirect de l'étain électrolysé :
1) réduction : I2 (aq) + 2 e- = 2 I-(aq) ; oxydation : Sn2+(aq) = Sn4+(aq)
+ 2 e-
2) a) quantité de
matière de diiode : n = c . V = 1,0.10-2
x 10,0.10-3 = 1,0.10-4 mol
b) Réaction
2 : 2 S2O32-(aq)
+ I2 (aq) = S4O62-(aq)
+ 2 I-(aq)
A l'équivalence,
les réactifs ont été mélangés dans les proportions stœchiométriques de l'équation
:
2 n(I2) = n( S2O32-) Þ n2
= n(I2) = c' . V ' / 2 = 5,0.10-3 x 9,7.10-3 / 2
= 2,4.10-5 mol
c) n = n(I2)réagi
+ n2 où n(I2)réagi
est la quantité de I2 qui a réagi avec les ions Sn2+
de la solution.
D'après l'équation
de la réaction 1, nSn2+ = n(I2)réagi
= n – n2 = 7,6.10-5 mol
d) D'après la question
I) 3), nSn = nSn2+ = 7,6.10-5
mol .
mSn =
nSn . MSn = 7,6.10-5 x 118,7 = 9,0.10-3 g =
9,0 mg
©Sciences Mont Blanc