Correction Bac Nouvelle Calédonie Novembre 2004
Calculatrice autorisée
I ) Deux isotopes de l'iode pour étudier la thyroïde (4 points)
II ) Etat final d'un système chimique : étude par spectrophotométrie (6,5 points)
III ) Le lancer du poids au championnats
du monde 2003 (5,5 points)
I ) (spe) (4 points)
Nouvelle Calédonie Novembre 2004 - I ) Deux isotopes
de l'iode pour étudier la thyroïde :
1) Le noyau de l'isotope 13153I contient
53 protons (Z) et 78 neutrons ( A – Z = 131 – 53 = 78)
2) N0 = n . NA = (m / M) . NA = (1,00.10-6 / 131) x 6,02 1023 = 4,60.1015 atomes.
3) Il y a conservation du nombre global de nucléons et du nombre global de
charge
13153I est radioactif b-., il se désintègre en émettant un électron 0-1 e
13153I ® 0-1 e + AZ X 131 = A + 0 ; A = 131 ; 53 = -1 + Z ; Z = 54
Le noyau produit est donc 13154 Xe . équation : 13153I ® 0-1 e + 13154 Xe
4.1) loi de décroissance radioactive : N(t)
= N0 . e- l . t
4.2.1) La demi-vie t½ d'un échantillon radioactif est le temps
au bout duquel la moitié de la quantité initiale de noyaux a été désintégrée.
N(t + t1/2) = N(t) / 2.
4.2.2) N(t1/2) = N0 / 2
; N0. e - l . t1/2 = N0 / 2 ; ln(e - l . t1/2 ) = ln(1/2) ;
- l . t1/2 = - ln 2 ; ln 2 = l . t½.
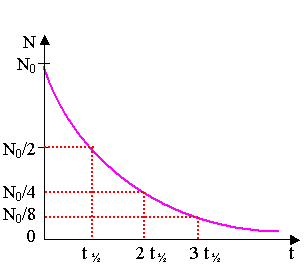
4.3) N(t1/2) = N0
/ 2 ;
N(2t1/2) = N(t1/2) / 2 = N0 / 4 ;
N(3t1/2)
= N(2t1/2) / 2 = N0 / 8
5.1) N(t) = N0 . e- l . t ; dN(t)/dt = - l . N(t) ; A(t) = l . N(t)
5.2) A0 = l . N0 = N0
. ln 2 / t1/2 ; t1/2 = 8 x 24 x 60 x 60 = 6,91.105
s
A0 = 4,60.1015 x ln 2 / 6,91.105 = 4,61.109 Bq
5.3) A4h = A0 . e - l . t
= 4,61.109 x exp ( - (ln 2 / 6,91.105) x (4 x 60 x 60))
= 4,54.109 Bq
5.4) |DA|/A0 = |A(t)-A0| / A0
= (4,61.109 -
4,54.109) / 4,61.109 = 0,015 = 1,5 %
6) t1/2(123I) = 13,2 h = 4,75.104 s.
A0 = 4,61.109 Bq ; A / A0 = e - l' . t ; t = ( ln(A0 / A) ) / l' = ( ln(A0 / A) ) . t1/2 / ln 2
t = (ln (4,61.109 / 4,54.109)) . 4,75.104 / ln 2 = 1048 s = 17 min 28s
Cette durée est donc plus courte que celle obtenue avec de l'isotope 13153I.
©Sciences Mont Blanc
I ) Suivi spectrophotométrique de la transformation chimique.
1) On peut suivre la cinétique d'une réaction par pH-métrie si la réaction implique des ions H3O+ ou HO- , ou par conductimétrie si la réaction le permet, ou par mesure de pression d'un gaz
2) a) A = k . c ; k = A / c = 1,70 / 5,0.10-3 = 3,4.102 L.mol-1
b) A(t) = k . [I2] = k . n(I2)(t) / (V1+V2) ; n(I2)(t) = A(t).(V1+V2) / k
c) n(I2)(90) = 0,79 x (10,0 + 10,0).10-3 / 3,4.102 = 4,6.10-5 mol
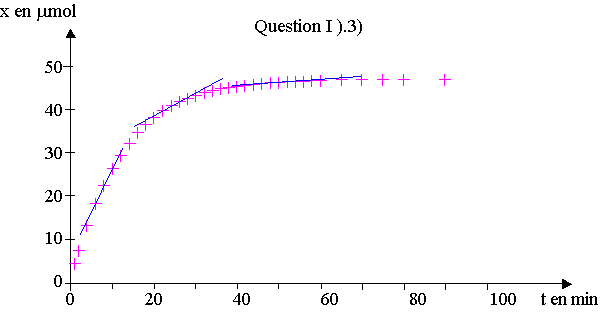
3) a) dx/dt correspond au coefficient directeur de la tangente à la courbe.
En traçant la tangente à différents points de la courbe , on constate que le coefficient diminue au cours du temps, la vitesse volumique diminue au cours du temps.
b) Au cours du temps, les concentrations des réactifs diminuent,
or c'est un facteur cinétique, cela diminue la vitesse de réaction.
c) Pour accélérer la réaction, on peut chauffer le mélange
réactionnel, ou ajouter un catalyseur de la réaction. Cela ne modifie pas
le mélange final.
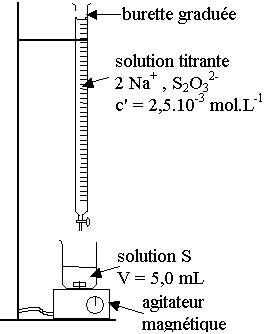 II ) titrage du diiode formé après 90 minutes
de réaction.
II ) titrage du diiode formé après 90 minutes
de réaction.
1) schéma du dispositif de titrage :
2) A l'équivalence, les réactifs ont été mélangés dans les proportions stœchiométriques de l'équation :
n(S2O32-)versé = 2 n(I2)0
3) Exploitation du titrage.
a) n(I2)0 = n(S2O32-)versé / 2 = c' . V'E / 2 (quantité dans un volume de 5 mL)
On cherche la quantité de I2 dans les 20 mL de solution, il faut donc multiplier par 4.
n(I2)90 = 2 c' . V'E
b) n(I2)90
= 2 x 2,5.10-3 x 9,2.10-3 = 4,6.10-5 mol
c) Cette valeur est la même que celle trouvée au I )2) .
III ) Etude théorique et bilan comparatif.
1) 2 I-(aq) = I2 (aq) + 2 e- et S2O82-(aq) + 2 e- = + 2 SO42-(aq) .
On les ajoute pour obtenir : 2 I-(aq)
+ S2O82-(aq) = I2 (aq) + 2 SO42-(aq)
2) a) n(I-)0 = c1 . V1 = 5,0.10-1 x 10,0.10-3 = 5,0.10-3 mol
n(S2O32-(aq))0 = c2 . V2 = 5,0.10-3 x 10,0.10-3 = 5,0.10-5 mol
|
Relation stœchiométrique |
2 I-(aq) + S2O82–(aq) = I2 (aq) + 2SO42–(aq) |
||||
|
Etat du système |
Avancement |
Quantité de matière en mol |
|||
|
Etat initial |
0 |
5,0.10-3 |
5,0.10-5 |
0,0 |
0,0 |
|
Au cours de la transformation |
x |
5,0.10-3 – 2x |
5,0.10-5 - x |
x |
2 x |
|
Etat final attendu |
xmax |
5,0.10-3 - 2xmax |
5,0.10-3 - xmax |
xmax |
2 xmax |
b) Si I- est le réactif limitant, n(I-)f = 0 = 5,0.10-3 - 2xmax ; xmax = 5,0.10-3 / 2 = 2,5.10-3 mol
Si S2O32- est le réactif limitant, n(S2O32-)f = 0 = 5,0.10-5 - xmax ; xmax = 5,0.10-5 mol
Le réactif limitant est donc S2O32- et xmax = 5,0.10-5 mol
D'après le tableau, n(I2)f = xmax = 5,0.10-5 mol
3) Par spectrophotométrie, on trouve n(I2) = 4,6.10-5
mol.
Par dosage, on trouve la même valeur pour n(I2).
D'après la question précédente, n(I2)th = 5,0.10-5 mol
½exp(I2) – nth(I2) ½/ nth(I2) = ½4,6.10-5 – 5,0.10-5½/ 5,0.10-5 = 0,080 = 8,0 %
Ce faible écart peut s'expliquer par des erreurs expérimentales de mesures.
©Sciences Mont Blanc
Nouvelle Calédonie Novembre 2004 - III ) Le lancer du poids aux championnats du monde 2003 :
1 ) Etude des résultats de la simulation :
1.1) D'après la figure 1, v0x = 10 m.s-1 ; vx est constante, le mouvement sur l'axe Ox est donc uniforme ; vSx = v 0x = 10 m.s-1
1.2) D'après la figure 2, v0y = 9,5 m.s-1
v0 = ![]() (v0x2
+ v0y2) =
(v0x2
+ v0y2) = ![]() (102 + 9,52)
= 13,8 m.s-1
(102 + 9,52)
= 13,8 m.s-1
tan a = v0y / v0x = 9,5 / 10 = 0,95 ; a = 43,5°
Les différences de résultats s'explique par le manque de précision du graphique.
1.3) Etude du vecteur vitesse du centre d'inertie du boulet.
Au sommet de la trajectoire, le vecteur vitesse est horizontal vers la droite sinon le boulet continue à monter.
vSx = 10 m.s-1 ; vSy = 0 m.s-1 ; vS = vSx = 10 m.s-1
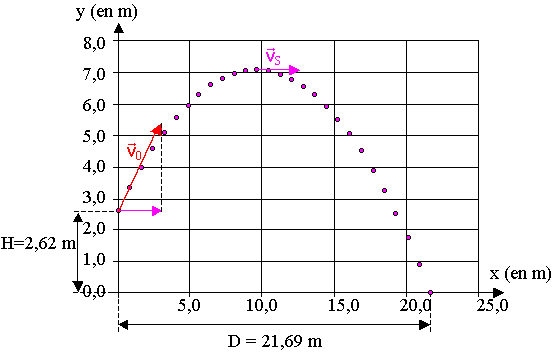
Pour être cohérent, il faut que la projection de v0 sur Ox (v0x) soit de même longueur que vS.
2) Etude théorique du mouvement du centre d'inertie.
2.1) PA = mair déplacé . g = m'.V.g ; P = mboulet . g = m .V.g
PA / P = (m'.V.g ) / (m.V.g ) = m' / m = 1,29 / 7,10.103 = 1,82.10-4
PA est donc négligeable devant P.
2.2) Les forces exercées par l'air sont négligeables, le poids est donc la seule force exercée sur le boulet, force verticale vers le bas.
On applique la 2ème loi de Newton, dans le référentiel terrestre supposé galiléen :
P = m . a ; a = g
2.3) Projection sur l'axe Ox : ax = gx = 0 = dvx /dt
On intègre selon la variable t : vx= constante = v0x = v0 . cos a = dx/dt
On intègre selon la variable t : x = v0 . cos a . t + constante
A t = 0s, x = constante = x0 = 0. x = v0 . cos a . t
Projection sur l'axe Oy : ay = gy = - g = dvy /dt
On intègre selon la variable t : vy= - g . t + constante
A t = 0s, vy = constante = v0y = v0 . sin a . vy = - g . t + v0 . sin a = dy/dt
On intègre selon la variable t : y = - ½ g . t2 + v0 . sin a . t + constante
A t = 0s, y = constante = y0 = h. y = - ½ g . t2 + v0 . sin a . t + h
2.4) t = x / (v0.cos a). On remplace dans l'autre équation.
y = - ½ g . x2 /(v0 .cos a)2 + tan a . x + h
3 ) Comment améliorer la performance du lanceur ?
3.1)
|
angle a fixé |
vitesse initiale v0 fixée |
|
Quand v0 augmente, la distance horizontale D du jet augmente |
Quand a augmente, la distance horizontale D du jet augmente, passe par un maximum puis diminue |
3.2) Parmi les combinaisons proposées, on peut battre le record du monde avec a = 41° et
v0 = 14 m.s-1 puisque la vitesse v0 est supérieure à 13,8 m.s-1 la distance D est plus grande que 21,69 m (cas de la figure 4).
©Sciences Mont Blanc
Nouvelle Calédonie Novembre 2004 - I )
(spécialité) :
©Sciences Mont Blanc
