Correction Bac Polynésie Septembre 2004
Calculatrice autorisée
I ) Voyager en se repérant : le GPS et les horloges (satellites - ondes) (9,5 points)
II ) Oxydo-réduction (2,5 points)
III ) Estérification (4 points)
III ) Titre alcalimétrique d'une eau minérale (4 points)
Correction Polynésie Septembre 2004 - I ) Voyager
en se repérant : le GPS et les horloges : (satellites)
I ) Les satellites :
1) Dans le référentiel géocentrique supposé galiléen, on applique la deuxième loi de Newton au satellite :
m . G =
G = ![]() T®Sat. (1)
T®Sat. (1)
On utilise le repère de Frenet : soit u
vecteur unitaire normal à la trajectoire et  vecteur unitaire tangent à la trajectoire.
vecteur unitaire tangent à la trajectoire.
 G =
G =  N +
N +  T = aN.
T = aN. N + aT.
N + aT. T ; aN
= v2 / d et
aT = dv/dt
T ; aN
= v2 / d et
aT = dv/dt
 T®Sat = FT®Sat .
T®Sat = FT®Sat . N . D'après
la relation (1) , on a :
N . D'après
la relation (1) , on a :
m.v2 / (RT+h)= G.m.MT / (RT+h)2 (2) et m.dv/dt = 0 (3)
On a donc dv/dt = 0, la vitesse est donc constante, le mouvement est donc circulaire et uniforme.
2) D'après la relation (2), v =  (G.MT/ (RT+h))
(G.MT/ (RT+h))
3) v =
 (6,67.10-11
x 5,98.1024 / (6380.103+20180.103)) = 3 875
m.s-1 = 13 950 km.h-1
(6,67.10-11
x 5,98.1024 / (6380.103+20180.103)) = 3 875
m.s-1 = 13 950 km.h-1
v = D / T = 2 π r / T
T = 2 π r / v = 2 x 3,14 x (6380.103+20180.103) / 3875 = 4,30.104 s = 12 h
Cela correspond aux données de l'énoncé.
4) Ces satellites ne sont pas géostationnaires car un tel satellite a une période de 24 h.
©Sciences Mont Blanc
Correction Polynésie Septembre 2004 -
I ) Voyager en se repérant : le GPS et les horloges : (ondes)
©Sciences Mont Blanc
Correction Polynésie Septembre 2004 - II )Oxydo-réduction :
1) équation : Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq)
2) Q r, i = [Zn 2+] i / [Cu2+] i = (n(Zn 2+) i /VT)/ (n(Cu2+) i/VT) = n(Zn 2+) i / n(Cu2+) i = c1.V1 / c2.V2
Qr, i = ( 0,20 x 20.10-3 ) / ( 0,20 x 20.10-3 ) = 1
3) Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq) K = 1037 = Qr, eq
D'après le critère d'évolution spontanée, Qr, i < K, le système chimique évolue dans le sens direct de l'équation, dans le sens de la formation de Cu(s) et Zn2+(aq) et de la disparition de Cu2+(aq) et Zn(s)
K > 104 , on peut donc considérer la réaction quasi totale.
Cela correspond aux observations, décoloration de la solution initialement bleue et formation de métal cuivre sur la lame de zinc.
Partie 2 : Application aux piles
1) Le pont salin sert à fermer le circuit pour que le courant circule et à assurer l'électroneutralité des solutions en apportant les ions nécessaires.
2) Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq) K = 1037 = Qr, eq
Q r, i = [Zn 2+] i / [Cu2+] i = 0,20 / 0,20 = 1.
D'après le critère d'évolution spontanée, Qr, i < K, le système chimique évolue dans le sens direct de l'équation, dans le sens de la formation de Cu(s) et Zn2+(aq) et de la disparition de Cu2+(aq) et Zn(s)
L'électrode de cuivre donne des électrons aux ions Cu2+ pour former du métal Cu . Il s'agit donc de la borne positive de la pile. L'électrode de zinc est donc la borne négative de la pile.
3) A l'électrode de cuivre : Cu2+(aq) + 2 e- = Cu(s)
A l'électrode de zinc : Zn(s) = Zn 2+(aq) + 2 e-
Bilan : Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq)
4) La représentation formelle de la pile est : ! Zn(s) / Zn 2+(aq) // Cu2+(aq) / Cu(s) Å
Le courant circule dans le circuit extérieur de la borne + de la pile vers la borne – de la pile.
5) Pour que la pile fonctionne, il faut que le système chimique
évolue, il doit être hors équilibre. Lorsqu'il a atteint l'équilibre, il n'évolue
plus et la pile est usée.
©Sciences Mont Blanc
Correction Polynésie Septembre 2004 - III ) Estérification
:
Partie 1 :
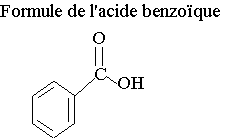
1) L'alcool A donne son nom à la 2ème partie du nom
de l'ester méthyle. Il s'agit donc du méthanol.
2) C6H5–COOH + CH3–OH = C6H5–COO–CH3 + H2O
Partie 2 :
1)
|
Equation chimique |
C6H5–COOH+ CH3–OH = C6H5–COO–CH3 + H2O |
||||
|
Etat du système |
Avancement |
Quantité de matière en mol |
|||
|
Etat initial |
0 |
0,20 |
0,20 |
0,0 |
0,0 |
|
En cours de transformation |
x |
0,20 – x |
0,20 – x |
x |
x |
|
Etat final |
xéq |
0,20 – xéq |
0,20 – xéq |
xéq |
xéq |
2) Qr, éq = ([C6H5–COO–CH3]éq.[H2O]éq) / ([C6H5–COOH]éq.[CH3–OH]éq) = xéq2 / (0,20 – xéq)2
Qr, éq = K = 4 = xéq2 / (0,20 – xéq)2 ⇒ xéq / (0,20 – xéq) = 2 ⇒ xéq = 0,40 – 2 xéq
xéq = 0,40 / 3 = 0,13 mol
Remarque : La valeur de K est donnée avec un seul chiffre significatif, ce qui est insuffisant !!
On devrait donc donner la valeur de xéq avec un chiffre significatif, ce qui ne convient pas !!
3) Si la réaction était totale, 0,20 – xmax = 0 ⇒ xmax = 0,20 mol
taux d’avancement : τ = xéq / xmax = 0,13 / 0,20 = 0,65 = 65 %
4) n(C6H5–COO–CH3)f = n(H2O)f = xéq = 0,13 mol ;
n(C6H5–COOH)f = n(CH3-OH)f = 0,20 – xéq = 0,20 – 0,13 = 7,0.10-2 mol
5) Qr, éq = ([C6H5–COO–CH3]éq.[H2O]éq) / ([C6H5–COOH]éq.[CH3–OH]éq)
Qr,éq = x'éq2 / [(0,20 – x'éq).(0,50 – x'éq)] = K = 4
x'éq2 = 4 ( 0,10 – 0,70 x'éq + x'éq2) ; 3 x'éq2 – 2,8 x'éq + 0,40 = 0
∆ = 2,82 – 4 x 3 x 0,40 = 3,04
; ![]() ∆ = 1,74
∆ = 1,74
x'1 éq = ( 2,8 – 1,74) / (2 x 3 ) = 0,18 mol ;
x'2 éq = ( 2,8 + 1,74) / (2 x 3 ) = 0,76 mol , c'est impossible car cette valeur est supérieure aux quantités initiales des réactifs.
x'éq = 0,18 mol
6) Si la réaction était totale, la quantité finale du réactif limitant serait nulle.
Pour l'ester, 0,20 – xmax = 0 ⇒ xmax = 0,20 mol. Pour l'alcool, 0,50 – xmax = 0 ⇒ xmax = 0,50 mol.
Le réactif limitant est donc l'ester et xmax = 0,20 mol
taux d’avancement : τ = x'éq / xmax = 0,18 / 0,20 = 0,88 = 88 %
On constate qu'en augmentant une quantité d'un réactif, le taux d'avancement final augmente.
Plus la concentration des réactifs est grande, plus le taux d'avancement final augmente.
©Sciences Mont Blanc
Correction Polynésie Septembre 2004 - III
) Titre alcalimétrique d'une eau minérale (spe):
I ) Le titre alcalimétrique TA
1) Le pH de l’eau minérale correspondant à la valeur du pH
du graphique pour Va = 0 mL.
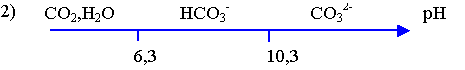
pH(eau) »
7,0
6,3 < pH(eau) < 10,3 , l'espèce prédominante est donc HCO3- .
3) La phénolphtaléine est incolore dans cette eau car pH < 8.
4) Par ajout d’acide chlorhydrique, le pH va diminuer, la phénolphtaléine
reste incolore.
En utilisant la phénolphtaléine, on ne peut pas déterminer par l’observation un volume équivalent car la solution reste incolore
5) Si on ajoute de l'acide chlorhydrique, le pH va diminuer, aucun ion CO32-
n'est présent.
La valeur du TA de cette eau minérale est nulle.
II ) Le titre alcalimétrique complet TAC
1) HCO3-(aq) + H3O+ (aq) = CO2,H2O + H2O(l)
2) na = Ca.Va = 2,0.10-2 x 14,0.10-3 = 2,8.10-4
mol
Si Va = 14 mL, pH » 5 (d'après le graphique), n'a = 10-5 x (50 + 14).10-3 = 6,4.10-7 mol
Cette quantité est négligeable par rapport à celle ajoutée.
Cette réaction est rapide et totale, on peut donc l'utiliser comme réaction de dosage.
3) Le point équivalent correspond à la valeur minimum de la dérivée dpH/dVa.
D'après le graphique, Véq = 14,5 mL et pHéq = 4,5
4) Le vert de bromocrésol est bien adapté car pHéq est situé dans
sa zone de virage.
5) D'après l'équation de dosage, à l'équivalence, n(HCO3-)0
= na éq
C.V1 = Ca.Véq Þ C = Ca.Véq / V1 = 2,0.10-2 x 14,5.10-3 / 50.10-3 = 5,8.10-3 mol.L-1
6) T = C.M(CO32-) = 5,8.10-3 x (12 + 3 x
16) = 0,35 g.L-1
7) Ca.Va = C.Veau Þ Va = C.Veau / Ca = 5,8.10-3 x 100
/ 2,0.10-2 = 29 mL
D'après la définition, TAC = 29
©Sciences Mont Blanc


