Correction Bac Pondichéry Mars 2004
I ) Chute libre et parachutisme (9 points)
II ) Fabrication puis titrage de l'aspirine (3 points)
III ) Lampe à vapeur de sodium (4 points)
III ) (spe) Guitare et physique (4 points)
Correction Pondichéry Mars 2004 - I ) Chute libre
et parachutisme :
Partie A - Le grand saut :
1.1) F = G.m.MT / (RT + h)2
1.2) P = F Þ m.g = G.m.MT / (RT + h)2 Þ g = G.MT / (RT + h)2
1.3) g = 6,67.10-11 x 5,97.1024 / ( 6,37.106 + 40.103 ) = 9,69 N.kg-1
Remarque : Plus l'altitude h est grande, plus g diminue. Or si h = 0 m, g » 9,8 N.kg-1 , le résultat trouvé est donc bien en accord !
2.1) La valeur 9,7 N.kg-1 donnée pour g dans l'énoncé confirme le résultat précédent.
Un objet est en chute libre s'il n'est soumis qu'à son poids.
2.2) Dans les conditions citées, on peut négliger la poussée
d'Archimède et la force de frottement fluide de l'air raréfié. La seule force
qui s'exerce sur le système est donc son poids P . On étudie le système ( parachutisme + équipement)
dans le référentiel terrestre galiléen auquel on associe un repère (O, i
) ( i
vecteur normé vertical vers le bas et O , point de départ du saut )
On applique la 2ème loi de Newton :
S
F
ext = m.a Þ P = m.a Þ g = a
Þ g.i = a.i Þ a = g
2.3) a = dv /dt = g Þ v = g.t + k ( k constante) ; à t = 0 s, v = k = v0 = 0 Þ v = g.t
t1 = v1 / g = ( 1067.103 / 3600 ) / 9,7 » 30,6 s. Cela correspond à la valeur de l'énoncé.
2.4) v = dx / dt = g.t Þ x = ½ g.t2 + k' ( k' constante) ; à t = 0 s , x = k' = 0 Þ x = ½ g.t2
x1 = ½ g.t12 = ½ 9,7 x 30,6 2 » 4 530 m. h1 = h – x1 = 40 000 – 4530 » 35 500 m
3.1) On préfère le terme célérité pour l'onde sonore car globalement, il n'y a pas de déplacement de matière (même si le son est une vibration de l'air), contrairement au déplacement d'un objet où on parlera de vitesse.
3.2) v = k.![]() T
Þ v2
= k2 .T Þ v12 /
v02 = T1 / T0 Þ T1 = T0 . v12 / v02
T
Þ v2
= k2 .T Þ v12 /
v02 = T1 / T0 Þ T1 = T0 . v12 / v02
Þ q1 + 273 = ( q0 + 273 ) . v12 / v02 Þ q1 = ( 0 + 273 ) .10672 / 11932 – 273 = - 54,6° C
Partie B : Le saut classique :
1.1) k = F /v2 ; [k] = [F] / [v]2 =[m.a] / [v]2 = M.( L.T-2 )/(L.T-1)2 =M.L-1 ; k se mesure en kg.m-1
1.2) Dans les conditions citées, on peut négliger la poussée d'Archimède de l'air raréfié. Les forces s'exerçant sur le système sont : son poids P et la force de frottement de l'air f . On étudie le système ( parachutisme + équipement) dans le référentiel terrestre galiléen auquel on associe un repère (O, i ) ( i vecteur normé vertical vers le bas et O , point de départ du saut )
On applique la 2ème loi de Newton : S F ext = m.a Þ P + f = m.a Þ m.g.i - k.v2.i = a.i
Þ a = dv / dt = g – (k / m).v2 Þ dv / dt = 9,8 – (0,28 / 80).v2 = 9,8 – 0,0035 v2
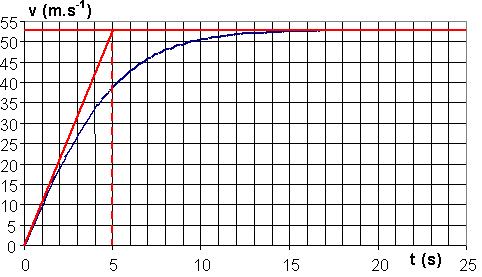
1.3.1) La courbe tend vers une valeur constante, vlim
de façon asymptotique.
D'après la courbe, vlim= 53 m.s-1.
Pour trouver le temps caractéristique tC , on trace la tangente à l'origine, elle coupe l'asymptote au temps t = tC = 5s.
1.3.2) dv / dt = g – (k / m).v2 ; lorsque la vitesse limite est atteinte, elle reste constante, dv/dt = 0.
0 = g - (k / m).vlim2 Þ g = k.vlim2 / m = 0,28 x 532 / 80 = 9,83 N.kg-1 .
1.4.1) Le pas utilisé Dt est de 0,10 s.
1.4.2) La méthode d'Euler consiste à assimiler dv/dt à Dv/Dt sur un intervalle de temps Dt très court. Dv = ai .Dt Þ vi+1 = vi + ai .Dt ; ai+1 = g - (k / m).vi2
à t4 = 0,40 s, v4 – v3 = a3 .Dt Þ v4 = v3 + a3 .Dt = 2,94 + 9,77 x 0,10 = 3,92 m.s-1
a4 = 9,8 – 0,0035 x 3,922 = 9,75 m.s-2
à t5 = 0,50 s, v5 – v4 = a4 .Dt Þ v5 = v4 + a4 .Dt = 3,92 + 9,75 x 0,10 = 4,89 m.s-1
a5 = 9,8 – 0,0035 x 4,892 = 9,72 m.s-2
1.5) D'après le graphique x = f(t) , à x = 1000 m ( sol atteint ) , t » 23 s
2.1) F' = k'.v2 à partir de t = 12 s.
L'équation différentielle devient : dv / dt = g – (k' / m).v2 .
Lorsque la vitesse limite est atteinte, elle reste constante, dv/dt = 0 Þ 0 = g - (k' / m).vlim2
Þ k' = m.g / vlim2 = 80 x 9,8 / 4,52 = 38,7 kg.m-1
2.2)

©Sciences Mont Blanc
Correction Pondichéry Mars 2004 - II )
Fabrication puis titrage d'aspirine :
1 ) Etude d'une estérification :
1.1) R-COOH + R'-CH2OH = R-COO-CH2-R' + H2O
1.2) voir Annexe 3
1.3) Le mélange initiale est équimolaire, les 2 réactifs sont donc en défaut, si la réaction était totale, leur quantité finale serait nulle : 0,2 – xmax = 0 Þ xmax = 0,2 mol
1.4) rendement : p = nester formé / nalcool initiale = xéq / xmax = 0,13 / 0,2 = 0,65 = 65 %
2 ) Synthèse de l'aspirine :
 2.1) L'anhydride A est issue de l'acide
formé , il s'agit de l'anhydride éthanoïque ou acétique :
2.1) L'anhydride A est issue de l'acide
formé , il s'agit de l'anhydride éthanoïque ou acétique :

2.2) Montage à reflux
Dans le ballon, on mélange
Ø l'acide salicylique,
Ø l'anhydride éthanoïque ,
Ø l'acide sulfurique,
Ø de la pierre ponce.
2.3) Notons B l'acide salicylique. nB 0 = mB 0 / MB = 5,00 / 138 = 0,0362 mol
nA 0
= mA 0 / MA = rA.VA 0 / MA = 1,08 x 7,0 / 102 = 0,0741 mol
( rA = dA . reau = 1,08 x 1 = 1,08 kg.L-1 = 1,08 g.mL-1
)
D'après l'équation, un mélange équimolaire serait stœchiométrique , l'anhydride est donc en excès et l'acide salicylique est le réactif limitant.
2.4) Si le rendement est de 100 %, tout le réactif limitant est consommé.
D'après l'équation , naspirine formée max = nacide consommé = nB 0 = 0,0362 mol
maspirine max = n.M = 0,0362 x 180 = 6,52 g
rendement effectif : h = nasp. formée / nasp. max= masp. formée / masp. max=4,20 / 6,52 =0,644 = 64,4 %
3) Titrage de l'aspirine :
3.1) n0 = C0 . V0 = 1,00 x 20,0.10-3 = 0,0200 mol
3.2) équation du dosage : H3O+(aq) + HO-(aq) ® 2 H2O(l) réaction rapide et totale
3.3) D'après l'équation, à l'équivalence, on a : n(H3O+)versé = n(HO-)initiale Þ C1.V1 = n1
n1 = 5,00.10-2 x 7,4.10-3 = 3,7.10-4 mol (quantité d'ions HO- présents dans 10 mL de solution S2 )
Soit C2 la concentration en ions HO- de la solution S2 :
C2 = n1 / Vprélevé = 3,7.10-4 / 10.10-3 = 3,7.10-2 mol.L-1
n2 est la quantité d'ions HO- en excès dans la solution S1 et aussi la quantité d'ions HO- présente dans 250 mL de solution S2 (on a simplement ajouté de l'eau (dilution)).
n2 = C2.V2 = 3,7.10-2 x 250.10-3 = 9,2.10-3 mol
3.4) n(HO-)consommé = n0 – n2 = 0,0200 – 9,2.10-3 = 0,011 mol
D'après l'équation, nasp = n(HO-)cons / 2 = 5,4.10-3 mol ; masp =n.M = 5,4.10-3 x 180 = 0,97 g
3.5) La valeur trouvée est très proche de la valeur attendue de 1,00 g.
Cet l'écart peut se justifier par des erreurs d'expérience lors du dosage (lecture de volume, prélèvement, pesée,…). Il est aussi probable que l'échantillon prélevé ne soit pas parfaitement pur, il peut contenir de l'eau, de l'alcool (recristallisation), de l'anhydride éthanoïque ou de l'acide éthanoïque.
ANNEXE 3 ( à rendre avec la copie )
Tableau d'avancement de la transformation liée à la réaction d'estérification
|
Equation |
R-COOH + R'-CH2OH = R-COO-CH2-R' + H2O |
||||
|
Etat |
Avancement (mol) |
Quantités de matière (mol) |
|||
|
RCOOH |
R'-CH2OH |
ester |
H2O |
||
|
Etat initial |
x = 0 |
0,20 |
0,20 |
0 |
0 |
|
Etat intermédiaire |
x |
0,20 - x |
0,20 - x |
x |
x |
|
Etat d'équilibre |
x = xéq = 0,13 mol |
0,20 – xéq = 0,07 |
0,20 – xéq = 0,07 |
xéq = 0,13 mol |
xéq = 0,13 mol |
.
©Sciences Mont Blanc
Correction Pondichéry Mars 2004 - III ) Lampe à vapeur
de sodium :
1.1) Les longueurs d'onde des raies appartenant au domaine du visible sont 568,8nm, 589,0 nm, 589,6nm et 615,4nm. Le domaine visible s'étend de 400 à 800 nm.
La raie à 330,3nm appartient au domaine des ultraviolets.
Les raies à 819,5nm et 1138,2 nm sont dans le domaine de l' infrarouge.
1.2) Cette lumière est polychromatique car son spectre indique la présence de 7 radiations monochromatiques différentes.
1.3) n = c / l = 3,00.108 / 589,0.10-9 = 5,09.1014 Hz
1.4) h est la constante de Planck et e est la charge élémentaire de l'électron
2.1) Voir diagramme.
2.2) La discontinuité du spectre d'émission d'une lampe à vapeur de sodium se justifie par la discontinuité des niveaux d'énergie du diagramme.
2.3) Raie jaune du doublet du sodium de longueur d'onde l = 589,0 nm.
2.3.1) DE = h.c / l = 6,62.10-34 x 3,00.108 / 589,0.10-9 = 3,37.10-19 J
1 eV = 1,6.10-19 J ; DE = 3,37.10-19 / 1,6.10-19 = 2,11 eV
( 3 chiffres significatifs , cela correspond à la donnée la moins précise )
Remarque : la formule DE = h.c / l peut se retrouver en utilisant les unités qui sont données)
2.3.2) Voir diagramme. La transition est entre les niveaux E1 et E2, le sens correspond à l'émission d'une radiation.
3.1) Cette radiation lumineuse peut interagir avec l'atome de sodium à l'état E1 car si on ajoute cette énergie à celle du niveau E1, on atteint le niveau E2 . – 3,03 + 1,09 = – 1,94 eV
3.2) Voir diagramme.
La raie associée à cette transition est une raie d'absorption car l'atome de sodium gagne de l'énergie, il reçoit de la lumière.
ANNEXE 4 :
Diagramme simplifié des niveaux d'énergie de l'atome de sodium

©Sciences Mont Blanc
Correction Pondichéry Mars 2004 - III )
(spe) Guitare et physique :
I ) Expérience 1 :
 1) Le mode de vibration correspondant
à f1 est le mode fondamental.
1) Le mode de vibration correspondant
à f1 est le mode fondamental.
La corde a la forme d'un fuseau unique.
2) Un fuseau a une longueur égale à l / 2. L = l / 2
v = l . f1 = 2 L . f1 = 2 x 0,642 x 82,4 = 106 m.s-1
3) Les autres modes de vibration sont les harmoniques.
L'harmonique d'ordre 3 de fréquence f3 forme 3 fuseaux.

 II ) Expérience 2 :
II ) Expérience 2 :
1) Il faut utiliser un oscilloscope à mémoire car le son émis est bref .
Il faut donc enregistrer les valeurs mesurées .
2) La période de vibration correspond à 3,4 div environ.
T = 3,4 x 2 = 6,8 ms
3) f = 1/ T = 1/ 6,8.10-3 = 147 Hz.
Cette valeur est en accord avec la fréquence du Ré de la corde 3
III ) Expérience 3 :
1) Une octave est l'intervalle entre 2 notes dont le rapport de fréquence vaut 2.
f(La3) = 4 f(La1)
2) a) Le diapason émet un son pur de fréquence 440 Hz.
Le spectre A correspond au son 3 car il n'y a pas d'harmoniques, le son est pur.
La corde 2 émet un son complexe dont la fréquence est de 110 Hz. Le spectre B correspond à ce son car la fréquence du fondamental qui est aussi celle du son, vaut 110 Hz.
La corde 3 émet un son complexe dont la fréquence est de 440 Hz. Le spectre C y correspond car la fréquence du fondamental vaut 440 Hz.
b) Les trois caractéristiques d'un son sont sa hauteur (liée à sa fréquence), son timbre et son niveau sonore.
Ce qui distingue les sons 1 et 2, est la hauteur car leurs fréquences sont différentes, f1 = 110 Hz et f2 = 440 Hz.
Les sons 2 et 3 ont la même fréquence de 440 Hz mais un timbre différent, le son 2 est complexe alors que le son 3 est pur.
©Sciences Mont Blanc
