Correction Bac Antilles Juin 2005
I ) Jeu de fête foraine (5,5 points)
II ) Détermination d'une constante d'équilibre par deux méthodes (6,5 points)
III ) Sonde thermique (4 points)
III ) Modulation d'amplitude (spe) (4 points)
Antilles Juin 2005 - I ) Jeu de fête foraine :
I ) Propulsion de la bille :
1) énergie potentielle élastique : Epe = ½ k .( l - l0 )2 ; ½ l – l0 ½ = ½x ½
( l0 :longueur du ressort au repos ; l : longueur du ressort à l'instant t)
Epe(A') = ½ k . xA' 2 = ½ x 25 x (10.10-2)2 = 0,125 J » 0,12 J
2) La bille lors de la détente du ressort acquiert de l'énergie cinétique.
Ec = ½ m.v2 ( m : masse en kg ; v : vitesse en m.s-1 )
3) énergie mécanique du système {ressort-bille} : Em = Epe + Epp + Ec
Epp = 0 J ; Em = ½ k . x2 + ½ m . v2 = ½ k . x2 + ½ m . x '2
Ec(A') = 0 J (v(A') = 0 m.s-1 ) ; Em(A') = Epe(A') = 0,125 J » 0,12 J
4) Si les frottements sont négligeables, l'énergie mécanique se conserve.
5) Em(O) = Em(A') ; Ec(O) + Epe(O) = Ec(A') + Epe(A')
Epe(O) = 0 J car x = 0 m ; Ec(O) = Epe(A') =0,125 J » 0,12 J
6) v =
![]() (2 Ec/m) ; vO
=
(2 Ec/m) ; vO
= ![]() (2 Ec(O)/m) =
(2 Ec(O)/m) =
![]() (2 x 0,125 / 10.10-3
) =
(2 x 0,125 / 10.10-3
) = ![]() (0,25.102)
= 5,0 m.s-1
(0,25.102)
= 5,0 m.s-1
7) Les forces appliquées à la bille entre O et C sont le poids P verticale vers le bas et la réaction normale du plan R verticale vers le haut. (On néglige les frotements)
On applique le théorème de l'énergie cinétique entre O et C dans le référentiel terrestre supposé galiléen : Ec(C) – Ec(O) = WOC(P) + WOC(R) = 0 J
P et R sont verticales, perpendiculaires au déplacement OC, leur travail est donc nul.
Ec(C) = Ec(O) ; vC = vO = 5,0 m.s-1
II ) Chute de la bille :
1) On néglige les frottements de l'air et la poussée d'Archimède de l'air.
La seule force appliquée à la bille est le poids P , elle est en chute libre.
On applique la deuxième loi de Newton dans le référentiel terrestre supposé galiléen :
m. a = P = m. g ; a = g
2) g = - g . j ; a = - g . j ; ax = 0 et ay = - g
3) On intègre les expressions précédentes : ax = dvx/dt = 0 ; vx = constante = vx 0 = vC
ay = dvy/dt = - g ; vy = - g . t + vy 0 = - g . t ( vy 0 = 0 m.s-1 )
On intègre une seconde fois : vx = dx/dt = vC ; x(t) = vC . t + x0 = vC . t ( x0 = 0 m)
vy = dy/dt = - g . t ; y(t) = - ½ g . t2 + y0 = - ½ g . t2 + CD
équations horaires : x(t) = vC . t et y(t) = - ½ g . t2 + CD
4) t = x(t) / vC . On remplace t dans la relation y(t) = - ½ g . t2 + CD ; ( CD = 0,05 m)
y(x) = - (g / 2vC2) x2 + CD ; y(x) = - (10 / (2 x 25)) x2 + 0,05 = - 0,2 x2 + 0,05
5) y(x) est nulle lorsque la bille tombe dans le trou. 0 = - 0,2 x2 + 0,05
xtrou = ![]() (0,05 / 0,2) =
(0,05 / 0,2) = ![]() (25.10-2) = 5.10-1 = 0,5 m ; Elle
tombe dans le trou F.
(25.10-2) = 5.10-1 = 0,5 m ; Elle
tombe dans le trou F.
©Sciences Mont Blanc
Antilles Juin 2005 - II ) Détermination
d'une constante d'équilibre par deux méthodes :
I ) La transformation chimique étudiée :
1) Un acide selon Brönsted est une espèce chimique capable de céder un proton H+.
2) Les deux couples acide/base mis en jeu sont : CH3CO2H(aq) / CH3CO2-(aq) et H3O+(aq)/ H2O(l)
3) constante d'équilibre : K = [CH3CO2-]éq.[H3O+]éq / [CH3CO2H]éq
II ) Etude pH-métrique :
1) n1 = c1 . V1 = 2,7.10-3 x 100.10-3 = 2,7.10-4 mol
2)
|
Equation chimique |
CH3CO2H(aq) + H2O(l) = CH3CO2-(aq) + H3O+(aq) |
||||
|
Etat du système |
Avancement (mol) |
Quantités de matière (mol) |
|||
|
Etat initiale |
x = 0 |
n1 |
excès |
0 |
0 |
|
En cours de transformation |
x |
n1 – x |
excès |
x |
x |
|
Etat final si transformation limitée |
x = xf |
n1 – x |
excès |
xf |
xf |
|
Etat final si transformation totale |
x = xmax |
n1 – x |
excès |
xmax |
xmax |
L'acide éthanoïque est le réactif limitant puisque l'eau est en excès.
Si la réaction était totale, n(CH3CO2H)f = 0 = n1 – xmax ; xmax = n1 = 2,7.10-4 mol
3) [H3O+]f = 10-pH = 10-3,70 = 2,0.10-4 mol.L-1 ( dans l'énoncé : log(2,0.10-4) = -3,7 )
n(H3O+)f = [H3O+]f . V1 ; d'après le tableau , n(H3O+)f = xf
xf = [H3O+]f . V1 = 2,0.10-4 x 100.10-3 = 2,0.10-5 mol
4) t1 = xf / xmax = 2,0.10-5 / 2,7.10-4 = (2 / 2,7).10-1 = 0,74.10-1 = 7,4.10-2 = 7,4 %
(on utilise le tableau de calculs du début du sujet: 2 / 2,7 = 0,74)
La transformation étudiée n'est pas totale, elle est limitée car t1 < 100 %
5) a) D'après le tableau, [CH3CO2-]f = [H3O+]f = 2,0.10-4 mol.L-1 (question I.3)
b) [CH3CO2H]f = c1 - [CH3CO2H]consommé = c1 - [CH3CO2-]f = 2,5.10-3 mol.L-1
6) K1 = [CH3CO2-]f.[H3O+]f / [CH3CO2H]f = (2,00.10-4)2 / 2,5.10-3 = (4 / 2,5).10-8+3 = 1,6.10-5
III ) Etude conductimétrique :
1) Les espèces ioniques majoritaires présentes dans cette solution sont CH3CO2- et H3O+ .
Les ions hydroxyde HO- sont négligeables d'après la valeur de pH de 3,70.
D'après l'équation, leurs concentrations molaires sont égales.
2) s = l(H3O+) . [H3O+]f + l(CH3CO2-) . [CH3CO2-]f = (l(H3O+) + l(CH3CO2-)) [H3O+]f
3) [H3O+]f = [CH3CO2-]f = s / (l(H3O+) + l(CH3CO2-))
[H3O+]f = [CH3CO2-]f = 5,00.10-2 / (35,9.10-3 + 4,1.10-3) = 5,00.10-2 / 40.10-3 = 1,25 mol.m-3
= 1,25.10-3 mol.L-1 .
4) a) [CH3CO2-]f / c2 = 1,25.10-3 / 1,0.10-1 = 1,25.10-2 < 50
L'approximation n°1 est donc justifiée.
b) En supposant que l'approximation n°2 soit vérifiée, la dissociation de l'acide est très faible.
La transformation chimique est donc très limitée, les produits formés sont en quantité très faible
c) K2 = = [CH3CO2-]f.[H3O+]f / [CH3CO2H]f = (1,25.10-3)2 / 1,0.10-1 = 1,56.10-6 x 101 = 1,56.10-5
d) t2 = [CH3CO2-]f / c2 = 1,25.10-3 / 1,0.10-1 = 1,25.10-2
IV ) Conclusion : Comparaison des résultats obtenus :
1) D'après le tableau, dans les deux études, on trouve la même valeur de K1 pour des concentrations initiales en acide éthanoïque différentes.
K1 ne dépend donc pas de la concentration initiale en acide éthanoïque.
2) D'après le tableau, dans les deux études, on trouve des valeurs différentes de taux d'avancement pour des concentrations initiales en acide éthanoïque différentes.
Le taux d'avancement final de la transformation chimique limitée dépend donc de l'état initial du système chimique.
3) Plus le taux d'avancement final t est grand, plus la quantité d'ions CH3CO2- est grande, plus l'acide est dissocié. L'affirmation 1 est donc juste.
D'après le tableau, plus la solution d'acide éthanoïque est diluée (concentration plus faible), comme dans l'étude pH-métrique, plus le taux d'avancement est grand ( t1 > t2 ), plus l'acide est dissocié. L'affirmation 2 est donc fausse.
©Sciences Mont Blanc
Antilles Juin 2005 - III ) Sonde thermique :
I ) Etalonnage de la soude :
1) Loi des tensions : E = uC + uR
2) i = dq / dt ; uC = q / C ; i = C . duC/dt ; uR = R . i = R.C.duC/dt
E = uC + R.C.duC/dt
3) a) Si t ® ¥, e- t /(R.C) ® 0, uC ® A . Or uC max = E, A = E.
b) A t = 0 s, uC(0) = E + B ( e0 = 1 ) . Or uC(0) = 0 V ; E + B = 0 ; B = - E
c) uC(t) = E . (1 – e- t / (R.C))
4) a) uR = R . i ; [R] = U . I-1 ; ; i = C.duC/dt ; [C] = I . T . U-1
[RC] = (U . I-1).( I . T . U-1) = T. t est bien homogène à un temps.
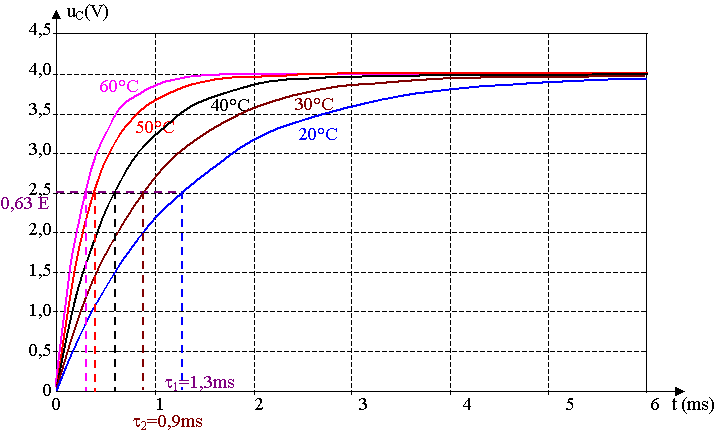
b) Pour déterminer t1 graphiquement, on utilise la règle des 63 % :
uC(t) = 0,63 E = 0,63 x 4,0 = 2,5 V. On reporte cette valeur sur la courbe et on lit le temps t1 .
D'après le tracé, t1 = 1,3 ms.
c) R1 = t1 / C = 1,3.10-3 / 1,0.10-6 = 1,3.103 W = 1,3 kW
d)
|
Température q(°C) |
q1 = 20 |
25 |
30 |
35 |
40 |
45 |
50 |
55 |
60 |
|
Constante de temps t (ms) |
t1 = 1,3 |
0,9 |
0,6 |
0,4 |
0,3 |
||||
|
Résistance R (k W) |
R1 = 1,3 |
1,07 |
0,9 |
0,74 |
0,6 |
0,49 |
0,4 |
0,34 |
0,3 |
e)
II ) Mesure d'une température :
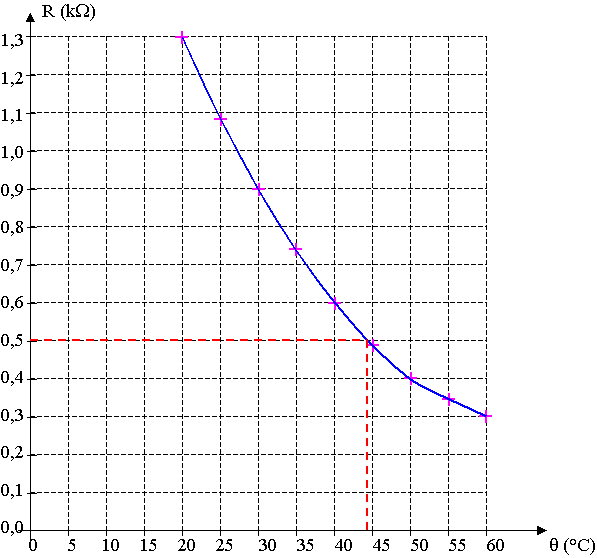
On reporte la valeur de la résistance et on lit la température q.
D'après le graphique, q » 44,5°C
©Sciences Mont Blanc
Antilles Juin 2005 - III ) Modulation d'amplitude
(spe) :
I ) La chaîne de transmission :
1) Le dispositif n°1 est le générateur HF, le n°2 est le multiplieur, le n°3 est l'amplificateur HF et le n°4 est l'antenne.
2) Le signal en B est le signal modulant BF noté uS(t) + U0 , celui en C est la porteuse notée uP(t) = UP (max).cos(2p.F.t) et celui en D est le signal modulé noté um(t)
3) La boîte noire est intercalée entre les points A et B est un dispositif qui amplifie le signal et qui ajoute une composante continue. (le microphone donne un signal électrique assez faible)
4) Le dispositif électrique (2) effectue une multiplication : (uS(t) + U0) x uP(t)
II ) La modulation d'amplitude :
1)
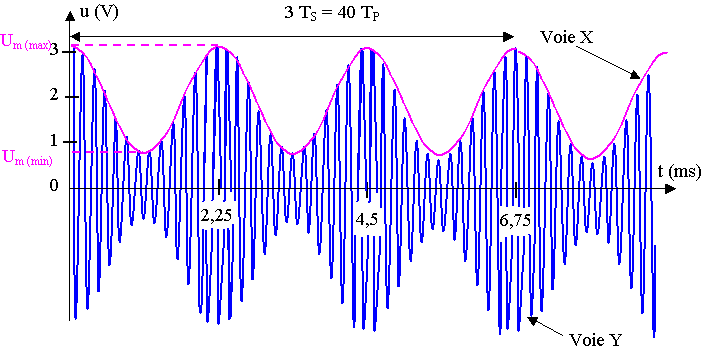
D'après le graphique, 3 TS = 40 TP = 6,75
ms
TS = 6,75/3 = 2,25 ms et TP = 6,75 / 40 = 0,169 ms
2) f = 1 / T ( f en Hertz et T en s)
f = 1 / TS = 1 / 2,25.10-3 = 103 x 0,444 = 444 Hz
F = 1 / TP = 1 / 0,169.10-3 = (40 / 6,75).103 = 5,93.103 Hz = 5,93 kHz
3) a) D'après le graphique, la tensions maximale Um (max) est voisine de 3,2 V et la tension minimale Um (min) de 0,8 V.
b) m = ( 3,2 – 0,8 ) / (3,2 + 0,8) = 2,4 / 4 = 0,6
c) Si le taux de modulation était supérieure à 1, on aurait un phénomène de surmodulation.
4) a) Le taux de modulation m est inférieure à 1 si US (max) < U0
b) Pour obtenir une bonne modulation, il faut que la fréquence F de la porteuse soit très grande devant celle du signal à moduler f.
c) f2 = F , f1 = F – f et f3 = F + f
©Sciences Mont Blanc