Correction Sujet Bac Nouvelle Calédonie Mars 2005
Calculatrice autorisée
I ) La tomographie par émission de positons : Une technique d'imagerie médicale (4 points)
II ) Le dihydrogène pour la protection de l'environnement(6,5 points)
III ) Oscillateur solide-ressort (5,5 points)
I )(spe) La lunette de Kepler (4 points)
Nouvelle Calédonie Mars 2005 - I ) La tomographie par émission de positons : Une technique d'imagerie médicale :
1 ) La désintégration de l’oxygène 15 :
1.1) Le numéro atomique Z correspond au nombre de protons. Z = 8
A correspond au nombre de nucléons (neutrons et protons). A = Z + N = 8 + 7 = 15
écriture symbolique du noyau d’oxygène 15 : 158O
1.2) équation : 158O ® 0+1e + 157N
1.3.1) On appelle énergie de liaison d'un noyau , notée El , l'énergie que le milieu extérieur doit fournir à un noyau au repos pour le dissocier en nucléons séparés au repos. El = Dm . c2
1.3.2) D'après la figure 1, la variation d’énergie DE1 correspond à l'énergie de liaison du noyau d'oxygène 15.
DE1 = (El / A)Ox15 . AOx15 = 7,463 x 15 = 111,9 MeV Cela correspond à la valeur donnée .
1.3.3) DE2 = Dm.c2 = (mf – mi) . c2 = ((7 mp + 8 mn + mpos) – ( 8 mp + 7 mn)) . c2
DE2 = ( mn + mpos –mp) . c2 = (1,67492 + 0,0009109 – 1,67262).10-27 x (2,998.108)2
DE2 = 2,886.10-13 J = 2,886.10-27 / 1,602.10-19 = 1,801.106 eV = 1,8 MeV
1.3.4) DE3 = - (El / A)N15 . A = - 7,699 x 15 = - 115,5 MeV
DE = DE1 + DE2 + DE3 = 111,9 + 1,8 – 115,5 = - 1,8 MeV
2 ) L’utilisation de l’oxygène 15 en TEP
2.1) Le temps de demi-vie t1/2 .est la durée au bout de laquelle la moitié des noyaux d'un échantillon se sont désintégrés.
2.2.1) N(t) = N0. e - l . t
A t = t1/2 , N(t1/2) = N0 / 2 = N0 . e - l . t1/2 . e l . t1/2 = 2 ; ln (e l . t1/2 ) = ln 2 ; l . t1/2 = ln 2
l = ln 2 / t1/2
2.2.2) l = ln 2 / 123 = 5,63.10-3 s-1
2.3) N(t1) = (5/100).N0 = N0 . e- l . t1 ; 0,05 = e - l . t1 ; ln(e - l . t1 ) = ln 0,05
t1 = - ln 0,05 / l = - ln 0,05 / 5,63.10-3 = 532 s » 9 min.
2.4) Il faut espacer les injections d'environ 9 min mais à ce stade d'évolution, le nombre de noyaux diminue lentement, on peut donc espacer les injections de 8 à 10 min.
3 ) La détection du rayonnement gamma :
3.1) équation : 0-1e + 0+1e ® 2 g
3.2) DE = Dm . c2 = ( 0 – mpositon - mélectron) .c2 = - 2 x 9,109.10-31 x (2,998.108)2 = - 1,637.10-13 J
DE = - 1022 keV
Ephoton = 1022 / 2 = 511 keV
Cette valeur est en accord avec celle donnée dans le texte .
©Sciences Mont Blanc
Nouvelle Calédonie Mars 2005 - II ) Le
dihydrogène pour la protection de l'environnement:
1 ) Principe de fonctionnement d’une cellule élémentaire :
1.1) Un oxydant gagne des électrons et le réducteur en perd.
L'oxydant est donc le gaz O2 et le réducteur est donc le gaz H2 .
Pour écrire l'équation globale, il faut que l'oxydation et la réduction mettent en jeu le même nombre d'électrons, il faut donc multiplier l'oxydation par 2.
H2 (g) = 2 H+(aq) + 2 e– ) x 2 ; O2 (g) + 4 H+(aq) + 4 e– = 2 H2O(l)
2 H2 (g) + O2 (g) + 4 H+(aq) = 4 H+(aq) + 2 H2O(l) Þ 2 H2 (g) + O2 (g) = 2 H2O(l)
1.2) Pour l’environnement, l’avantage d’une pile à combustible est de ne produire
que de l'eau et aucun polluant comme le gaz carbonique.
1.3) La réduction se produit toujours à la cathode, qui est donc l'électrode
1.
1.4)
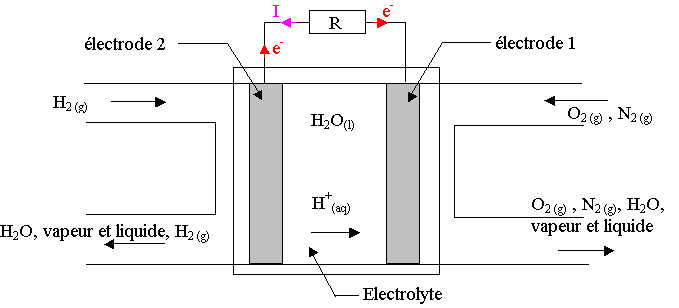
Le courant circule du pôle + de la pile vers le pôle – dans la résistance R.
Le pôle + est donc l'électrode 1 et le pôle – est donc l'électrode 2.
1.5) Un catalyseur est une espèce chimique qui accélère une réaction sans
la modifier.
1.6) q = I . t = n(e-) . NA . e
n(e- ) = I . t / (NA.e) = 300 x (192 x 60 x 60) / (6,02.1023 x 1,6.10-19) = 2,15.103 mol
D'après la réduction, n(O2 ) = n(e- ) / 4 = 5,38.102 mol
D'après l'oxydation, n(H2) = n(e- ) / 2 = 1,08.103 mol
2 ) Principe de production du dihydrogène par électrolyse au laboratoire :
2.1.1) équation de dissolution : Na2SO4 (s) = 2 Na+(aq) + SO42-(aq)
2.1.2) n(Na2SO4) = c . V
|
Equation |
Na2SO4 (s) = 2 Na+(aq) + SO42-(aq) |
|||
|
Etat du système |
Avancement |
Quantités de matière (en mol) |
||
|
Etat initial |
0 |
c . V |
0 |
0 |
|
Etat au cours |
x |
c . V - x |
2 x |
x |
|
Etat final |
xf |
c . V - xf |
2 xf |
xf |
2.1.3) n(Na+)f = 1,0 mol = 2 xf
; xf = 0,50 mol
Si la réaction était totale, n(Na2SO4)f = 0 mol.
c . V – xmax = 0 ; xmax = c . V = 1,0 x 500.10-3 = 0,50 mol
xf = xmax , la réaction est donc totale.
2.2) Qr, f = [Na+]f
2 . [SO42-]f
= ( 2 xf / V )2 . (xf / V) = 4 xf3
/ V3 = 4 x 0,503 / 0,503 = 4,0
2.3.1) L'oxydation a toujours lieu à l’anode : 2 H2O(l) = O2 (g) + 4 H+(aq) + 4
e–
La réduction a toujours lieu à la cathode : 2 H2O(l) + 2 e– = H2 (g) + 2 HO– (aq)
2.3.2) A la cathode, la solution devient basique à cause des ions hydroxyde
formés.
La forme basique du BBT colore la solution en bleu.
A l'anode, la solution devient acide à cause des ions H+(aq) .
La forme acide du BBT colore la solution en jaune.
2.3.3) Il faut que l'oxydation et la réduction mettent en jeu le même nombre
d'électrons.
2 H2O(l) = O2 (g) + 4 H+(aq) + 4 e–
2 H2O(l) + 2 e– = H2 (g) + 2 HO– (aq) ) x 2
6 H2O(l) = O2 (g) + 4 H+(aq) + 4 HO-(aq) + 2 H2 (g)
2 H2O(l) = O2 (g) + 2 H2 (g) réaction inverse de la réaction spontanée
2.3.4) En mélangeant les 2 solutions, les ions H+(aq)
et les ions HO-(aq)
forment des molécules d'eau et la solution est donc neutre. Les formes
du BBT donnent une couleur verte à la solution comme au début.
©Sciences Mont Blanc
Nouvelle Calédonie Mars 2005 - III ) Oscillateur solide-ressort
:
1 ) Etude théorique du mouvement du solide
1.1.1) Les trois forces qui s’exercent sur ce solide sont :
P : poids du solide, vertical vers le bas, P = m . g
R : réaction normale du plan , verticale vers le haut
F : force exercée par le ressort sur le solide, dans l'axe du ressort, F = - k . x . i
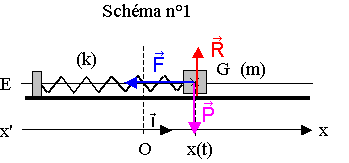
1.1.2) F = - k . x . i
Si x > 0 (cas du schéma), - k . x < 0, F et i sont bien de sens contraire.
Si x < 0 , - k . x > 0, F et i sont bien de même sens.
1.2.1) On applique la deuxième loi de Newton au solide dans le référentiel terrestre supposé galiléen :
F + R + P = m . a
Projection sur l'axe Ox : - k . x + 0 + 0 = m . ax = m . d2x/dt2 = m . x''(t)
x''(t) + (k / m). x = 0
1.2.2) x(t) = Xm . cos [(2p/T0).t + j0] ; x'(t) = - Xm . (2 p / T0) . sin [(2p/T0).t + j0]
x''(t) = - Xm . (2 p / T0)2 . cos [(2p/T0).t + j0] = - (2 p / T0)2 . x
x''(t) + (2 p / T0)2 . x = 0
D'après la question précédente, k / m = (2 p / T0)2
T0
/ 2 p = ![]() (m
/ k) ; T0
= 2p
(m
/ k) ; T0
= 2p
![]() (m
/ k)
(m
/ k)
 1.2.3) [2p
1.2.3) [2p ![]() (m
/ k)] = [ m / k ] 1 / 2
(m
/ k)] = [ m / k ] 1 / 2
F = k . x ; [k] = [ F / x ] = [F] / L ;
D'après la 2ème loi de Newton,
[F] = [m.a] = M.L.T-2
[k] = [F] / L = M.L.T-2 / L = M.T-2
[2p
![]() (m
/ k)] = ( M / ( M.T-2)) 1 / 2 = T
(m
/ k)] = ( M / ( M.T-2)) 1 / 2 = T
L’expression 2 p ![]() (m / k) est bien homogène
à un temps.
(m / k) est bien homogène
à un temps.
2 ) Retour à l’expérience :
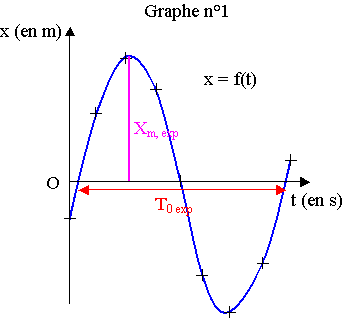
2.1) graphe n°1
2.2) Le résultat de la modélisation de la courbe donne : x = a.cos( b.t + c)
avec : a = 4,25.10-2 m, b = 21,18 rad.s-1 et c = 4,71 rad.
x = Xm . cos (2 p t / T0 + j0)
Xm, exp = a = 4,25.10-2 m ; 2 p / T0 exp = b ; T0 exp = 2 p / b = 2 p / 21,18 = 0,2966 s
2.3) T0
= 2 p ![]() (m
/ k) = 2 p
(m
/ k) = 2 p ![]() (0,0540 / 24,0) = 0,298
s
(0,0540 / 24,0) = 0,298
s
2.4) écart relatif : ½T0exp-T0½/ T0 = (0,298 – 0,2966) / 0,298 = 4,70.10-3 = 0,47 %
Cet écart est très faible et correspond aux erreurs expérimentales.
3 ) Aspect énergétique en l’absence de frottements :
3.1) Em = Ec + Ep él + Epp = Ec + Ep él ; Epp = m . g . z = 0 J ; Em = ½ m . v2 + ½ k . x2
3.2) On néglige les frottements, l'énergie mécanique se conserve donc au cours du temps.
Lorsque x vaut Xm , la vitesse est nulle. Em = ½ k . Xm2
Lorsque x est nul, la vitesse est maximale. Em = ½ m . Vm2
½ m . Vm2 = ½ k . Xm2 ; Vm2
= (k / m). Xm2 ; Vm
= Xm . ![]() (k /m) = Xm
. (2 p / T0)
(k /m) = Xm
. (2 p / T0)
Vm = 2p.Xm/ T0
3.3) Vm = 2p.Xm/ T0 = 2 p x 4,3.10-2 / 0,30 = 0,90 m.s-1
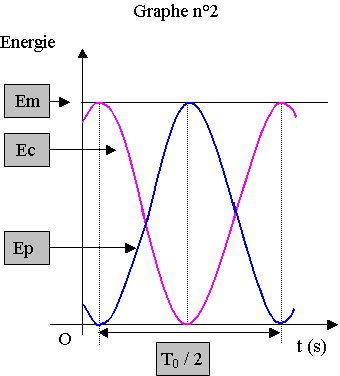
3.4) Au début, x est faible, Ep est donc faible, il s'agit donc de la courbe bleue.
L'énergie mécanique est constante, il s'agit donc de la courbe noire.
Lorsque Ep est maximale, x = xm , la vitesse est nulle, Ec est nulle, cela correspond à la courbe rouge.
Pour déterminer la durée fléchée , on suit la courbe sur les deux graphiques.
Au début, pour x = 0, Ep = 0 J et Ec = Ec max.
Puis x augmente, Ep augmente et Ec diminue.
Pour x = xm , v = 0 m.s-1 , Ep = Ep max et
Ec = Ec max.
Puis x diminue, Ep diminue et Ec aumente.
A nouveau x = 0, Ep = 0 J et Ec = Ec max.
Cela correspond à la durée encadrée du graphe 2 et à la durée de T0/2 pour le graphe 1.
4 ) Aspect énergétique en présence de frottements :
4.1) Si on tient compte des frottements, il y a amortissement au cours du temps, le régime est alors pseudo périodique, Xm diminue à chaque oscillation.
Le temps caractéristique T correspondant est nommé pseudo période.
4.2.1) A t = 0s, x = Xm0 , v0 = 0 m.s-1 , Em0 = Ec0 + Ep0 = ½ m . v02 + ½ k . Xm02 = ½ k . Xm02
4.2.2) Au bout d'une oscillation, x1 = Xm0 / r , v1 = 0 m.s-1 , Em1 = ½ k . (Xm0 / r )2
Em1 = ½ k . Xm02 / r2 = Em0 / r2
©Sciences Mont Blanc
Nouvelle Calédonie Mars 2005 - I ) (spe)La
lunette de Kepler :
©Sciences Mont Blanc