Sujet Bac Nouvelle Calédonie Novembre 2005
Calculatrice autorisée
I ) Propagation des ondes (4 points)
II ) Deux antiseptiques (6,5 points)
III ) Datation des séismes en
californie ( points)
I ) Etude d'une corde de piano (spe) (4 points)
Nouvelle Calédonie Novembre 2005 - I ) Propagation des ondes :
Cet exercice est un questionnaire à réponses ouvertes courtes. A chaque question
peuvent correspondre aucune, une ou plusieurs propositions exactes.
Pour chacune des questions, plusieurs réponses ou affirmations sont proposées.
Inscrire en toutes lettres « vrai » ou « faux » dans la case correspondante du tableau figurant dans l'Annexe à rendre avec la copie.
Donner une justification ou une explication dans la case prévue à cet effet.
Une réponse fausse ou une absence de réponse sera évaluée de la même façon.
Les parties 1, 2, 3 et 4 sont indépendantes et peuvent être traitées séparément.
1 ) Ondes infrasonores.
Les éléphants émettent des infrasons (dont la fréquence est inférieure à 20 Hz).
Cela leur permet de communiquer sur de longues distances et de se rassembler.
Un éléphant est sur le bord d’une étendue d’eau et désire indiquer à d’autres éléphants sa présence. Pour cela, il émet un infrason. Un autre éléphant, situé à une distance L = 24,0 km, reçoit l’onde au bout d’une durée Dt = 70,6 s.
La valeur de la célérité de l’infrason dans l’air v est :
v = 34,0 km.s-1 ;
v = 340 km.s-1 ;
v = 340 m.s-1 .
2 ) Ondes à la surface de l’eau
Au laboratoire, on dispose d’une cuve à onde contenant de l’eau immobile à la surface de laquelle flotte un petit morceau de polystyrène. On laisse tomber une goutte d’eau au-dessus de la cuve, à l’écart du morceau de polystyrène. Une onde se propage à la surface de l’eau.
2.1) Ceci correspond :
2.1.1) à une onde mécanique ;
2.1.2) à une onde longitudinale ;
2.1.3) à une onde transversale ?
2.2) L’onde atteint le morceau de polystyrène.
2.2.1) Celui-ci se déplace parallèlement à la direction de propagation de l’onde ;
2.2.2) Celui-ci se déplace perpendiculairement à la direction de propagation de l’onde ;
2.2.3) Celui-ci monte et descend verticalement ;
2.2.4) Celui-ci reste immobile.
3 ) Ondes le long d’une corde
L’extrémité gauche d’une corde est reliée à un vibreur effectuant des oscillations sinusoïdales entretenues à partir d’un instant de date t0 = 0 s. Les graphiques 1 et 2 représentent l’état de la corde à une date donnée. Les élongations y et les abscisses x sont graduées en cm. On néglige tout amortissement dans la totalité des questions de cette partie 3.
3.1) Le graphique 2 ci-dessus permet de déterminer la valeur numérique de la longueur d’onde l.
On trouve :

3.1.1. l = 20 cm ;
3.1.2. l = 30 cm ;
3.1.3. l = 46 cm .
3.2) A partir des graphiques 1 et 2, déterminer la valeur de la période temporelle
T :
3.2.1. T = 30 ms ;
3.2.2. T = 60 ms ;
3.2.3. T = 18 ms .
3.3) La célérité de l’onde dans la corde est :
3.3.1. v = 5,0 m.s-1 ;
3.3.2. v = 10,0 m.s-1 ;
3.3.3. v = 15,0 m.s-1 .
3.4) Dans la même expérience, parmi les graphes 3, 4, 5 et 6 ci-dessous, celui
représentant l’aspect de la corde à l’instant de date t = 180 ms est le :
3.4.1. graphe 3 ;
3.4.2. graphe 4 ;
3.4.3. graphe 5 ;
3.4.4. graphe 6 .

4 ) Ondes lumineuses
4.1) La propagation de la lumière visible :
4.1.1) montre que c’est une onde mécanique ;
4.1.2) s’effectue avec une célérité plus petite dans l’eau
que dans le vide (indice de réfraction
de l’eau : n = 1,3) ;
4.1.3) s’effectue avec la même célérité, dans un milieu dispersif donné, quelle que soit la fréquence de la radiation.
4.2) La lumière rouge :
4.2.1) correspond à des longueurs d’onde plus grandes que celles de la lumière bleue ;
4.2.2) se situe
dans un domaine de fréquences plus petites que celles du domaine de
l’infrarouge ;
4.2.3) est moins énergétique que la lumière bleue.
4.3) La lumière visible peut être diffractée.
4.3.1) Le phénomène de diffraction de la lumière visible par une fente est plus marqué pour une fente de largeur 0,5 mm que pour une fente de largeur 5 mm ;
4.3.2) Pour une lumière monochromatique, l’écart angulaire
du faisceau diffracté par une fente
est proportionnel à la largeur de la fente ;
4.3.3) L’écart angulaire du faisceau diffracté par une fente de largeur donnée est plus petit pour une radiation rouge que pour une radiation bleue.
Annexe Exercice
|
Proposition |
Répondre |
Justification ou explication |
|
1.1. |
||
|
1.2. |
||
|
1.3. |
||
|
2.1.1. |
||
|
2.1.2. |
||
|
2.1.3. |
||
|
2.2.1. |
pas de justification |
|
|
2.2.2. |
||
|
2.2.3. |
||
|
2.2.4. |
||
|
3.1.1. |
||
|
3.1.2. |
||
|
3.1.3. |
|
Proposition |
Répondre |
Justification ou explication |
|
3.2.1. |
||
|
3.2.2. |
||
|
3.2.3 |
||
|
3.3.1. |
||
|
3.3.2. |
||
|
3.3.3. |
||
|
3.4.1. |
pas de justification |
|
|
3.4.2. |
||
|
3.4.3. |
||
|
3.4.4. |
||
|
4.1.1. |
||
|
4.1.2. |
||
|
4.1.3. |
||
|
4.2.1. |
||
|
4.2.2. |
||
|
4.2.3. |
||
|
4.3.1. |
||
|
4.3.2. |
||
|
4.3.3 |
©Sciences Mont Blanc
Nouvelle Calédonie Novembre 2005 - II )Deux
antiseptiques :
Le Lugol et l’eau oxygénée sont deux antiseptiques couramment utilisés. Les indications portées sur deux flacons de solutions commerciales contenant chacun un de ces antiseptiques sont données dans le tableau ci-dessous.
|
Lugol (solution S0) |
eau oxygénée (solution S1) |
|
Composition : iodine solution (eau iodée) |
Composition : eau oxygénée stabilisée. Titre : 10 volumes. Solution pour application locale. Usage externe. |
On se propose dans cet exercice de tracer une courbe d’étalonnage à l’aide
d’un spectrophotomètre afin d’utiliser cet appareil pour :
- déterminer le titre de la solution S0 de Lugol ;
- étudier la cinétique d’une transformation chimique mettant en jeu l’eau oxygénée.
Les parties 2. et 3. sont indépendantes et peuvent être traitées séparément.
1 ) Courbe d’étalonnage du spectrophotomètre
On dispose de six solutions aqueuses de diiode de concentrations molaires apportées différentes. La mesure de l’absorbance A de chaque solution a été réalisée avec un spectrophotomètre UV–visible réglé à la longueur d’onde l = 500 nm.
Le spectrophotomètre utilisé admet une gamme de mesures pour l’absorbance de A0 = 0 à
Amax = 2,00.
Parmi les espèces chimiques présentes le diiode est la seule espèce qui absorbe à 500 nm.
Les résultats obtenus permettent de tracer la courbe d’étalonnage de la Figure 1 de l’Annexe à rendre avec la copie.
1.1) Justifier, à partir de la courbe d’étalonnage, que les grandeurs portées sur le graphe sont liées par une relation de la forme
A = k . [I2].
1.2) On note [I2]max la concentration molaire apportée en diiode au-delà de laquelle l’absorbance d’une solution de diiode n’est pas mesurable par le spectrophotomètre utilisé ici.
Déterminer graphiquement la valeur de [I2]max en faisant clairement apparaître la méthode utilisée sur la Figure 1 de l'Annexe à rendre avec la copie.
2 ) Titre du Lugol
Pour déterminer le titre en diiode du Lugol, il est ici nécessaire de diluer dix fois la solution commerciale S0. La solution obtenue est notée S0’.
Le matériel mis à disposition est le suivant :
- bechers 50 mL, 100 mL, 250 mL ;
- pipettes jaugées 5,0 mL, 10,0 mL, 20,0 mL ;
- éprouvettes graduées 10 mL, 20 mL, 100 mL ;
- fioles jaugées 100,0 mL, 250,0 mL, 500,0 mL.
2.1) Choisir, sans justification, le matériel nécessaire pour préparer S0’.
2.2) Sans modifier les réglages du spectrophotomètre, on mesure l’absorbance de la solution S0’ A(S'0) = 1,00.
2.2.1) Déterminer graphiquement sur la Figure 1 de l'Annexe à rendre avec la copie, la concentration molaire apportée en diiode de la solution S0’. On fera clairement apparaître la méthode graphique utilisée.
2.2.2) En déduire la concentration molaire apportée cL en diiode du Lugol (solution commerciale S0)
2.2.3) Pourquoi a-t-il été nécessaire de diluer le Lugol (solution commerciale S0) ?
3 ) Etude cinétique d’une transformation chimique mettant en jeu l’eau oxygénée et libérant du diiode
La transformation qui a lieu dans l’étude proposée est modélisée par la réaction dont l’équation d’oxydoréduction s’écrit :
H2O2 (aq) + 2 I –(aq) + 2 H3O+(aq) = I2 (aq) + 4 H2O (l)
La mesure de l’absorbance du diiode présent dans le milieu réactionnel, à longueur d’onde 500 nm, permet de suivre l’évolution temporelle de la quantité de diiode formé et de réaliser ainsi un suivi cinétique.
La courbe A = f(t) est donnée sur la Figure 2 de l'Annexe à rendre avec la copie.
Afin de réaliser ce suivi cinétique :
- on prépare une solution S2 (concentration c2) 10 fois moins concentrée que la solution S1 (concentration c1) d’eau oxygénée commerciale ;
- on mélange dans un bécher, V = 5,0 mL d’acide sulfurique et V3 = 9,0 mL d’une solution aqueuse d’iodure de potassium,
K +(aq) + I –(aq) ;
- à l’instant de date t0 = 0 s, on introduit rapidement, dans ce becher, un volume V2 = 1,0 mL de la solution S2 d’eau oxygénée H2O2 (aq).
Un échantillon du milieu réactionnel est versé dans une cuve que l’on introduit dans le spectrophoto-mètre.
Dans les conditions de l’expérience, les ions iodure I - (aq) et les ions oxonium H3O+(aq) sont introduits en excès par rapport à l’eau oxygénée.
3.1) Définir un oxydant.
3.2) Ecrire les couples oxydant/réducteur mis en jeu dans la réaction étudiée et les demi-équations électroniques correspondantes.
3.3) Compléter littéralement, en utilisant les notations de l’énoncé, le tableau descriptif de l’évolution du système donné sur la Figure 3 de l'Annexe à rendre avec la copie.
3.4) A l’aide de ce tableau, établir l’expression de l’avancement x(t) de la réaction en fonction de [I2](t), la concentration molaire en diiode présent dans le milieu réactionnel et de Vtot volume du mélange.
3.5) On rappelle que l’absorbance est liée à la concentration molaire volumique du diiode par la relation A = k[I2]. Sachant que la vitesse volumique v(t) de réaction est définie par la relation :
v(t) = (1/Vtot).dx(t)/dt , où Vtot est le volume du mélange réactionnel, montrer que : v(t) = (1/k).dA(t)/dt.
3.6) On note v0 la vitesse volumique de réaction à l’instant de date t0 = 0 min et v1 celle à l’instant de date t1 = 5,0 min.
3.6.1) Parmi les relations données ci-dessous, choisir celle qui convient, en justifiant graphiquement, à partir de la Figure 2 de l'Annexe à rendre avec la copie.
v0 > v1 v0 < v1 v0 = v1
3.6.2) En faisant appel aux connaissances de cours, dire pourquoi v(t) subit cette évolution.
3.7) Transformation totale ou limitée.
Une détermination précise de la valeur de k (constante de proportionnalité intervenant dans la relation de la question 1.1.) donne k = 246 L.mol –1.
Le volume de la solution est Vtot = V + V2 + V3 = 15,0 mL
3.7.1) A partir des résultats expérimentaux donnés sur la Figure 2 de l'Annexe à rendre avec la copie , déterminer la valeur de l’avancement final xf de la transformation étudiée.
3.7.2) On admet qu’une solution commerciale d’eau oxygénée titrée à « 10 volumes » a une concentration molaire apportée en eau oxygénée c1 = 0,89 mol.L –1.
Déterminer la valeur du taux d’avancement final t de la transformation.
Conclure.
3.8) Temps de demi-réaction
Définir puis déterminer graphiquement la valeur du temps de demi-réaction t1/2 en faisant apparaître clairement la méthode utilisée sur la Figure 2 de l'Annexe à rendre avec la copie.
3.9) Conclusion
Déduire des réponses précédentes si la transformation chimique modélisée par la réaction d’équation :
H2O2 (aq) + 2 I –(aq) + 2 H3O+(aq) = I2 (aq) + 4 H2O (l)
peut servir de support à un titrage direct (c’est-à-dire sans faire intervenir une autre réaction) de l’eau oxygénée. Justifier la réponse.


Figure 3
|
relation stœchiométrique |
H2O2 (aq) + 2 I – (aq) + 2 H3O +(aq) = I2 (aq) + 4 H2O (l) |
|||||
|
état du système |
avancement |
bilan de matière en mol |
||||
|
état initial |
0 |
excès |
excès |
solvant |
||
|
au cours de la transformation |
x |
excès |
excès |
solvant |
||
|
état final |
xf |
excès |
excès |
solvant |
||
|
état final si la transformation est totale |
xmax |
excès |
excès |
solvant |
||
©Sciences Mont Blanc
Nouvelle Calédonie Novembre 2005 - III ) Datation des
séismes en californie :
©Sciences Mont Blanc
Nouvelle Calédonie Novembre 2005 - I )
Etude d'une corde de piano (spécialité) :
Cet exercice est un questionnaire à réponses ouvertes courtes. A chaque question peuvent correspondre aucune, une ou plusieurs propositions exactes.
Pour chacune des questions, chaque proposition doit être étudiée.
Inscrire en toutes lettres « vrai » ou « faux » dans la case correspondante du tableau figurant dans l'Annexe à rendre avec la copie.
Donner une justification ou une explication dans la case prévue à cet effet.
Une réponse fausse ou une absence de réponse seront évaluées de la même façon.
Les parties 1 et 2 sont indépendantes et peuvent être traitées séparément.
1 ) Etude d’une corde de piano
 On étudie le fonctionnement d’une
corde de piano placée dans le dispositif simplifié ci-contre (Figure 1).
On étudie le fonctionnement d’une
corde de piano placée dans le dispositif simplifié ci-contre (Figure 1).
Accrochée à un support fixe en O, la corde est disposée verticalement.
Elle passe en M par le trou d’un support tel que la corde soit immobile en ce point.
On note OM = L. La longueur L vaut 42,2 cm.
A l’extrémité inférieure de la corde, est accrochée un solide de masse m.
Un électro-aimant, alimenté par un générateur basses fréquences délivrant une tension électrique sinusoïdale, permet d’exciter de façon sinusoïdale la corde à une fréquence f réglable.
Les fréquences de vibration f qui interviennent dans cet exercice sont toujours celles de la corde.
On fait varier la fréquence de vibration f de la corde de 200 à 2500 Hz.
A la fréquence f0 = 523 Hz, on observe à la lumière du jour un fuseau unique de plus grande amplitude.
On rappelle qu’une harmonique d’ordre n correspond à une fréquence propre de vibration de la corde donnée par n.f0 où f0 est la fréquence du mode fondamental de vibration de la corde et n un entier positif non nul.
1.1) A la fréquence f0 = 523 Hz, on observe :
1.1.1) un ventre et deux nœuds ;
1.1.2) un nœud et deux ventres ;
1.1.3) trois nœuds et deux ventres ;
1.1.4) un ventre et trois nœuds.
1.2) La fréquence f0 = 523 Hz est la fréquence :
1.2.1) de l’harmonique d’ordre 1 ;
1.2.2) de l’harmonique d’ordre 2 ;
1.2.3) du mode fondamental.
1.3) A la fréquence de vibration f1 = 1046 Hz, on observe :
1.3.1) toujours 1 fuseau unique mais d’amplitude double ;
1.3.2) 2 fuseaux d’amplitudes importantes ;
1.3.3) 2 nœuds.
1.4) La quantification des modes propres est donnée par la relation (avec n nombre entier) :
1.4.1) nl = 2L ;
1.4.2) nl = L ;
1.4.3) nl = L / 2.
1.5) A la fréquence f0 = 523 Hz, la célérité des ondes sur la corde vaut :
1.5.1) 340 m.s-1 ;
1.5.2) 3,00.108 m.s-1 ;
1.5.3) 441 m.s-1 ;
1.5.4) 221 m.s-1.
2 ) Etude d’une corde placée dans un piano
Les extrémités d’une corde placée dans un piano, sont reliées à une caisse de résonance en bois.
L’expression de la célérité des ondes sur la corde en fonction
de sa masse linéique (µ) et de sa tension (F) est : v = ![]() (F / m).
(F / m).
2.1) La caisse de résonance permet :
2.1.1) d’augmenter la hauteur du son produit par la corde ;
2.1.2) d’augmenter le niveau sonore du son ;
2.1.3) d’entretenir les vibrations de la corde.
2.2) Pour augmenter la hauteur du son émis par la corde en vibration, il faut :
2.2.1) tendre davantage la corde ;
2.2.2) détendre la corde.
3 ) Etude de la note émise par un piano
Dans cette partie, on néglige tout phénomène d’amortissement.
On étudie une corde de longueur L = 42,2 cm présente dans un piano, reliée à la touche « do4 » de l’instrument.
Le pianiste en appuyant sur la touche « do4 » frappe cette corde par l’intermédiaire d’un marteau. Celle-ci oscille librement.
On effectue l’enregistrement de la tension électrique u(t) aux bornes d’un microphone placé à côté de la corde oscillante à l’aide d’un dispositif d’acquisition informatisé. On obtient l’enregistrement simplifié (Figure 2) ci-dessous :

3.1) Le mode fondamental de la corde correspond à la fréquence :
3.1.1) 184 Hz ;
3.1.2) 276 Hz ;
3.1.3) 552 Hz ;
3.1.4) 1104 Hz .
3.2) Le spectre de fréquence correspondant au son émis par la corde de piano est l’un des spectres proposés ci-dessous : (figures 3.a., 3.b., 3.c. ou 3.d.) où r est le rapport de l’amplitude de l’harmonique considéré sur l’amplitude de l’harmonique fondamentale.
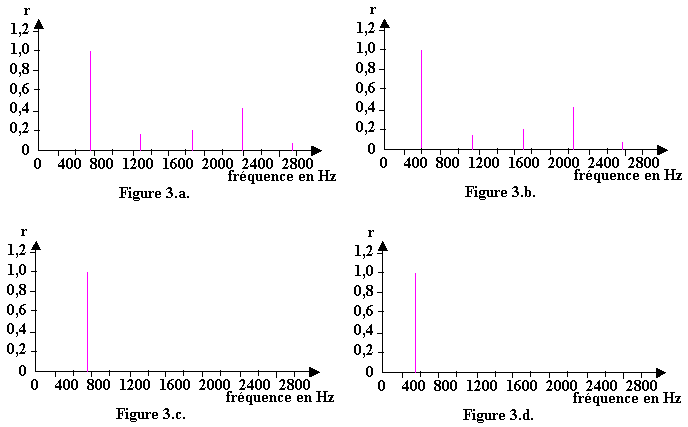
Le son émis par la corde reliée à la touche « do4 » est un son complexe.
Le spectre de fréquences correspond
3.2.1) à la figure 3.a. ;
3.2.2) à la figure 3.b. ;
3.2.3) à la figure 3.c. ;
3.2.4) à la figure 3.d. .
3.3) Le tableau ci-dessous récapitule les fréquences, en hertz, de notes de quelques cordes bien accordées du piano.
|
si3 |
494 |
si4 |
988 |
si5 |
1976 |
||
|
la3 |
440 |
la4 |
880 |
la5 |
1760 |
||
|
sol3 |
392 |
sol4 |
784 |
sol5 |
1568 |
||
|
fa3 |
349 |
fa4 |
698 |
fa5 |
1397 |
||
|
mi3 |
330 |
mi4 |
659 |
mi5 |
1318 |
||
|
ré3 |
294 |
ré4 |
587 |
ré5 |
1175 |
||
|
do3 |
262 |
do4 |
523 |
do5 |
1046 |
Des réponses données précédemment, on peut affirmer que :
3.3.1) la corde étudiée est bien accordée ;
3.3.2) la corde étudiée est mal accordée.
Annexe
|
Proposition |
Répondre vrai ou faux |
Justification ou explication |
|
1.1.1. |
||
|
1.1.2. |
||
|
1.1.3. |
||
|
1.1.4. |
||
|
1.2.1. |
||
|
1.2.2. |
||
|
1.2.3. |
||
|
1.3.1. |
||
|
1.3.2. |
||
|
1.3.3. |
||
|
1.4.1. |
pas de justification |
|
|
1.4.2. |
||
|
1.4.3. |
||
|
1.5.1 |
||
|
1.5.2. |
||
|
1.5.3. |
|
Proposition |
Répondre vrai ou faux |
Justification ou explication |
|
2.1.1. |
pas de justification |
|
|
2.1.2. |
||
|
2.1.3. |
||
|
2.2.1. |
||
|
2.2.2. |
||
|
3.1.1. |
||
|
3.1.2. |
||
|
3.1.3. |
||
|
3.1.4. |
||
|
3.2.1. |
||
|
3.2.2. |
||
|
3.2.3. |
||
|
3.2.4. |
||
|
3.3.1. |
||
|
3.3.2. |
©Sciences Mont Blanc
