Correction Bac Polynésie Juin 2005
Calculatrice autorisée
I ) Etude d'un circuit RC - Principe de fonctionnement d'une minuterie (7,5 points)
III ) Etude d'un produit ménager (4 points)
III ) Titrage des ions chlorure présents dans un anti-diarrhéique (4 points)
Polynésie Juin 2005 - I ) Etude d'un circuit RC -
Principe de fonctionnement d'une minuterie :
I ) Etude du circuit RC :
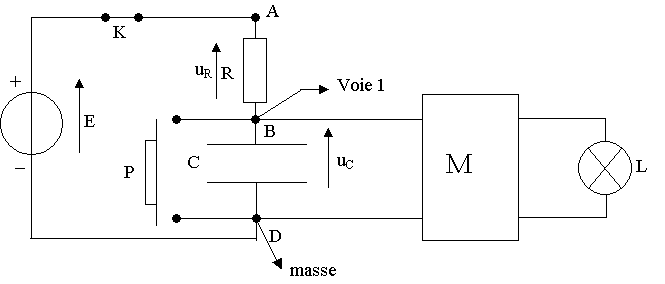
1) Pour visualiser uC sur la voie 1 de l'oscilloscope, on relie B à l'entrée de la voie 1 et D à la masse.
2) Loi des tensions : E = uR(t) + uC(t)
uR(t) = R . i(t) ; i(t) = dq(t)/dt = C.duC(t)/dt ( uC(t) = q(t) / C ) ; uR(t) = R.C.duC(t) /dt
uC(t) + R.C.duC(t)/dt = E (1)
3) a) uC(t) = A.(1 – e – t / t ) ; duC(t) /dt = (A/ t).e- t / t
(1) A.(1 – e – t / t ) + R.C.(A / t).e – t / t = E
A ( (R.C/ t) – 1).e – t / t = E – A
Pour que cette relation soit vérifier quelque soit l'instant t, il faut que E = A et R.C/ t – 1 = 0
On a donc A = E et t = R.C
b) En régime permanent, t est grand, e –t / t est très petit devant 1, uC = A = E = 30 V
c) t est la constante de temps du circuit.
uR = R . i ; [R] = U . I-1 ; ; i = C.duC/dt ; [C] = I . T . U-1
[RC] = (U . I-1).( I . T . U-1) = T.
L'unité de la constante t est donc la seconde (s).
4) La tension E correspond à la valeur maximale de uC.
Pour déterminer t graphiquement, on peut tracer la tangente à l'origine, elle coupe l'asymptote
u = E au temps t = t, mais cette méthode est peu précise. On peut aussi trouver t en calculant la valeur de uC(t), soit 0,63 E ( 19 V) et en reportant sur la courbe .
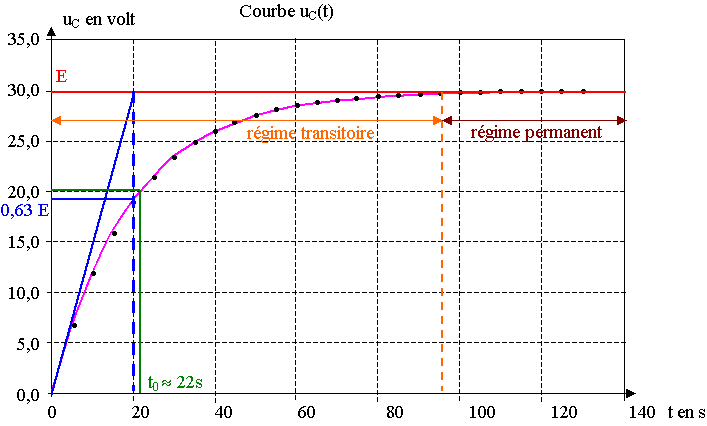
5) t = R.C = 100.103 x 200.10-6 = 2,00.10 = 20 s
Cette valeur correspond à celle déterminée graphiquement.
6) a) uC(t0) = Ul = E.(1 – e- to / t ) ; (E – Ul)/ E = e – to / t ; t0 = t . ln (E/(E – Ul))
b) t0 = 20 x ln(30 /(30 – 20)) = 22 s
On lit sur le graphique, pour uC égale à 20 V , t0 » 22s.
c) Si on choisit t0 très supérieur à t, on se trouve sur le graphique sur une partie de la courbe presque plate, il faudrait donc une valeur très précise de Ul pour avoir un temps t0 précis , si on est un peu au dessus de Ul, t0 change beaucoup. On n'a pas ce problème au voisinage de t.
7) t0 est proportionnel à t, soit R.C. On peut donc augmenter t0 en augmentant R et/ou C.
t = R.C = t0 / ln (E/(E – Ul)) ;
R = t0 / ( C.ln(E/(E – Ul))) = 60 / ( 200.10-6.ln(30 / (30 – 20))) = 2,7.10 5 W = 273 kW
8) Le bouton poussoir relie les points B et D par un fil, la tension uC est donc nulle.
uC est donc inférieure à Ul
a) Si la lampe est déjà allumée, elle reste allumée lorsqu'on appuie sur le bouton poussoir..
b) Si la lampe est éteinte, elle s'allume lorsqu'on appuie sur le bouton poussoir.
II ) Méthode d'Euler :
1) duC(t)/dt = (E – uC(t)) / (R.C) = 1,50 – uC(t) / 20
2) uC(2) = uC(0) + (duC(0)/dt). Dt = 0 + 1,50 x 2 = 3,00 V
duC(2)/dt = 1,50 – uC(2) / 20 = 1,50 – 3,00 / 20 = 1,35 V.s-1
uC(4) = uC(2) + (duC(2)/dt). Dt = 3,00 + 1,35 x 2 = 5,70 V
duC(4)/dt = 1,50 – uC(4) / 20 = 1,50 – 5,70 / 20 = 1,21 V.s-1
|
t(s) |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
... |
20 |
|
uC(t) |
0 |
3,00 |
5,70 |
8,14 |
10,3 |
12,3 |
14,1 |
… |
19,6 |
|
duC(t)/dt |
1,50 |
1,35 |
1,21 |
1,09 |
0,99 |
0,89 |
0,80 |
… |
0,52 |
3)
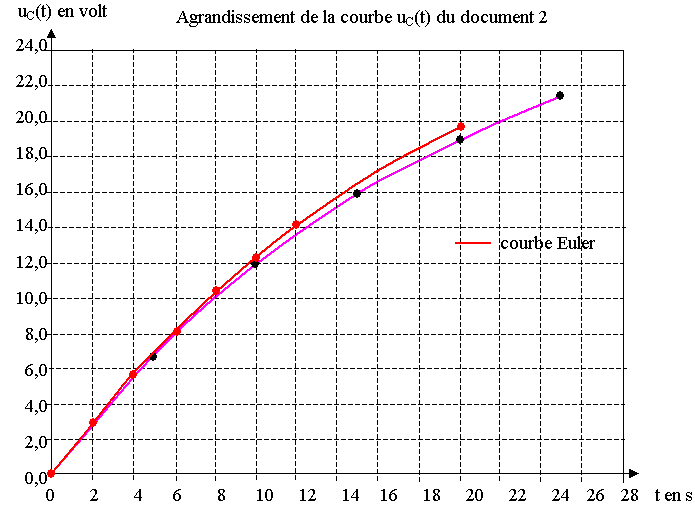
On constate que la courbe tracée avec les valeurs du tableau correspond bien au début
à la courbe réelle mais elle s'écarte peu à peu.
4) On peut améliorer la précision de la méthode d'Euler en diminuant la valeur du pas Dt mais l'inconvénient est que le nombre de calculs a effectué augmente beaucoup si on diminue Dt .
©Sciences Mont Blanc
Polynésie Juin 2005 - II ) Parlons CD :
I ) Lumière émise par un laser :
1) Une lumière de longueur d'onde voisine de 800 nm est de couleur rouge.
2) E = E1 – E2 = h . n ( n étant la fréquence de la lumière)
c = l / T = l . n ; n = c / l = 3,00.108 / 0,790.10-6 = 3,80.1014 Hz
E = h . n = 6,63.10-34 x 3,80.1014 = 2,52.10-19 J = 2,52.10-19 / 1,60.10-19 = 1,57 eV
II ) Caractère ondulatoire de la lumière :
1) Le phénomène est la diffraction de la lumière.
2) Sur l'écran, on observe une série de taches alignées horizontalement (perpendiculaire à la fente), avec au centre une tache de largeur double des autres.
Schéma : 
3) a) Si on diminue la largeur a de la fente, le phénomène de diffraction est plus marqué et la largeur des taches augmente.
tan q = L / 2D . q étant petit, tan q » q. Loi de la diffraction : q = l / a ; L » l /(2 a . D) (1)
La largeur L de la tache centrale est inversement proportionnelle à la largeur de la fente.
b) D'après la relation (1), si on diminue la longueur d'onde l, la largeur des taches diminue.
III ) Application à la lecture d'un CD :
A la question II ) 3) b), on constate qu'en diminuant l, on diminue la largeur de la tache centrale, on peut ainsi lire des informations plus petites, sous forme de cuvettes plus petites. On peut ainsi plus d'informations sur une même surface. La capacité du CD est plus grande.
IV ) Gravure d'un CD :
1) On veut un dépôt de nickel sur le glassmaster. Il faut réduire les ions Ni2+ en métal Ni, cela va consommer des électrons venant du circuit, ils sortent de la borne – du générateur qui est donc du côté du glassmaster. Le courant sort de la borne + du générateur et circule en sens inverse des électrons.
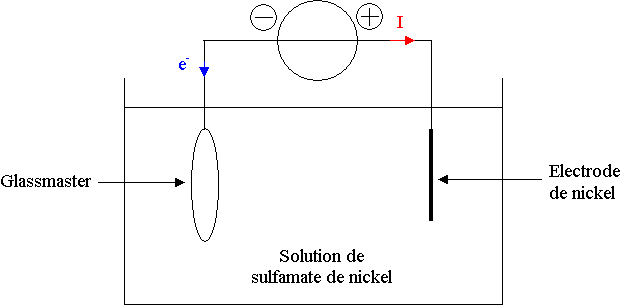
2) Il se produit une réduction sur le glassmaster, qui est donc la cathode, l'électrode de Nickel est donc l'anode.
Réduction à la cathode : Ni2+(aq) + 2 e- = Ni(s)
Oxydation à l'anode : Ni(s) = Ni2+(aq) + 2 e-
3) a) Volume de Nickel déposé : V = S . e (S :surface du disque et e : épaisseur )
V = p . (D/2)2 . e = 3,14 x (23,0.10-2 / 2)2 x 3,05.10-4 = 1,27.10-5 m3 = 12,7 cm3
mNi = r . V = 8,90 x 12,7 = 113 g
b) nNi = mNi / MNi = 113 / 58,7 = 1,92 mol
4) D'après la demi-équation de réduction : n(e- ) = 2 nNi = 3,85 mol
Q = n(e- ).NA.e. = I . t
I = n(e- ).NA.e / t = 3,85 x 6,02.1023 x 1,60.10-19 / (2 x 3600) = 51,5 A
Remarque : Les valeurs d'intensité sont souvent grandes.
©Sciences Mont Blanc
Polynésie Juin 2005 - III ) Etude d'un produit ménager
:
I ) NH3 :
1) a) Une base est une espèce chimique capable de capter un proton H+.
b) NH3(aq) + H2O(l) = NH4+(aq) + HO-(aq)
c) K = [NH4+]éq.[HO-]éq / [NH3]éq = [NH4+]éq.[HO-]éq.[H3O+]éq/ ([NH3]éq.[H3O+]éq)
Ka1 = [NH3]éq.[H3O+]éq/ [NH4+]éq ; K = KA2 / KA1 = 1,0.10-14 / 6,3.10-10 = 1,6.10-5
2) a) c = n(NH3)0 / V = 2,5.10-3 / 0,250 = 1,0.10-2 mol.L-1
b) [H3O+ ] = 10-pH = 10-10,6 = 2,51.10-11 mol.L-1
c) [HO-] = KA2 / [H3O+ ] = 4,0.10-4 mol.L-1
d) t = xf / xmax . D'après l'équation, xf = n(HO-)f = [HO-]f .V
L'eau étant en excès, l'ammoniac est le réactif limitant, xmax = n(NH3)0 = c . V
t = [HO-]f .V / (c .V ) = [HO-]f./ c
t = 4,0.10-4 / 1,0.10-2 = 4,0.10-2 = 4,0 %
e) t est faible, la transformation est donc limitée, équilibrée.
Ceci est confirmé par la valeur de K inférieure à 10-4.
II ) Détermination de la concentration en ammoniac de la solution commerciale :
1) Il faut une pipette jaugée et une fiole jaugée dont le rapport de volumes soit de 1/1000 pour obtenir la bonne dilution. Le lot 3 convient donc. Vpipette / Vfiole = 1/ 1000
2) a) A l'équivalence, les réactifs ont été mélangés dans les proportions stoechiométriques de l'équation et ont réagi complètement.
b) D'après l'équation , n(NH3 )0 = n(H3O+ )versé ; c1 . V1 = cA . VAE
c) c1 = cA . VAE / V1 = 1,50.10-2 x 14,3.10-3 / 20,0.10-3 = 1,07.10-2 mol.L-1
c0 = 1000 c1 = 10,7 mol.L-1
d) A l'équivalence, les réactifs ont réagi complètement et disparus, la solution contient donc de l'eau et des ions NH4+ , elle est donc acide, pH < 7. Dans l'énoncé, on indique gentiment 5,7, ce qui permet de choisir l'indicateur dont la zone de virage contient cette valeur de pH à l'équivalence, soit le rouge de chlorophénol.
©Sciences Mont Blanc
Polynésie Juin 2005 - III ) Titrage des
ions chlorure présents dans un anti-diarrhéique (spe):
I ) première partie :
Dans un tube à essais A contenant V1 = 2,0 mL de solution aqueuse de chlorure de sodium (Na+(aq) + Cl-(aq)) de concentration
c1 = 5,00.10-2 mol.L-1 , on ajoute V1 = 2,0 mL de solution de nitrate d'argent ( Ag+(aq) + NO3-(aq)) de concentration
c = 4,25.10-2 mol.L-1 et on observe la formation d'un précipité blanc.
1) Ag+(aq) + Cl-(aq) = AgCl(s)
Pour un titrage , la réaction doit être totale, on peut donc l'écrire : Ag+(aq) + Cl-(aq) ® AgCl(s)
2) quotient de réaction : Qr = 1 / ([Ag+].[Cl-])
3) Qr,i = 1 / [(c1.V1/ VT).( c.V1/ VT)] = 4 / (c1.c) = 4 / (5,00.10-2 x 4,25.10-2) = 1,88.103
4) Qr,i < K, d'après le critère d'évolution spontannée, la transformation est donc dans le sens direct de l'équation, sens de la formation de AgCl(s).
II ) Deuxième partie :
1) Pour préparer la solution de 200 mL d'Adiaril® , il faut prélever la solution (S) avec une pipette jaugée de 20 mL que l'on verse dans une fiole jaugée de 200 mL que l'on complète avec de l'eau distillée puis on agite.
2.1) Avant l'équivalence
a) s1 = l(Na+).[Na+]+l(K+).[K+]+l(Cl-).[Cl-]+l(Ci3-).[Ci3-] + l(gluc-).[gluc-] + l(NO3-).[NO3-]
Les ions Ag+ sont tous consommés au fur et à mesure qu'ils sont ajoutés.
b) Les ions chlorures sont peu à peu consommés, leur concentration diminue au cours du titrage, les ions NO3- sont peu à peu ajoutés, leur concentration augmente au cours du titrage. I
Ces ions Cl- et NO3- participent au terme D1.
Les concentrations des ions Na+, K+, Ci3- , gluc- ne varient pas au cours du titrage à condition de négliger les variations de volume, ils participent au terme B.
B = l(Na+).[Na+]+l(K+).[K+]+l(Ci3-).[Ci3-] + l(gluc-).[gluc-] ; D1 = l(Cl-).[Cl-]+l(NO3-).[NO3-]
c) Globalement, lorsqu'un ion chlorure est consommé, un ion nitrate est ajouté.
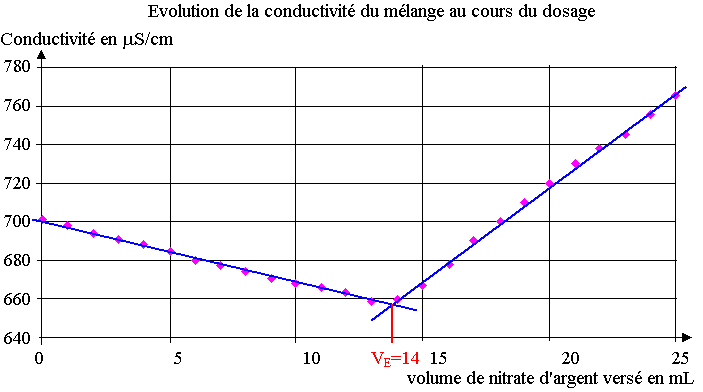
Or la conductivité ionique molaire des ions chlorure est supérieure à celle des ions nitrate, la conductivité du mélange diminue donc faiblement avant l'équivalence.
2.2) Après l'équivalence :
a) Tous les ions chlorures ont été consommés. On ajoute des ions Ag+ et NO3-
s2 = l(Na+).[Na+] + l(K+).[K+]+l(Ci3-).[Ci3-] + l(gluc-).[gluc-] + l(Ag+).[Ag+] + l(NO3-).[NO3-]
b) Seules les concentrations des ions Ag+ et NO3- augmentent, ils participent au terme D2.
Les ions Na+, K+, Ci3-, gluc- participent toujours au terme B.
B =l(Na+).[Na+]+l(K+).[K+]+l(Ci3-).[Ci3-]+l(gluc-).[gluc-] ; D1 = l(Ag+).[Ag+]+l(NO3-).[NO3-]
c) Les concentrations des ions Ag+ et NO3- augmentent, la conductivité du mélange augmente.
3) Exploitation :
3.1) On trace les droites représentant les courbes avant et après l'équivalence, le volume de la solution nitrate d'argent versé à l'équivalence se situe à l'intersection de ces deux droites.
VE = 14 mL
3.2) A l'équivalence, les ions Ag+ et Cl- ont été ajoutés dans les proportions stœchiométriques de l'équation :
n(Cl- )0 = n(Ag+ )versés ; cS . V2 = c. VE
cS = c . VE / V2 = 4,25.10-2 x 14.10-3 / 20,0.10-3 = 3,0.10-2 mol.L-1
3.3) mexp = nexp . M(Cl) = cS . V . M(Cl) = 3,0.10-2 x 200.10-3 x 35,5 = 0,21 g
3.4) ½mexp – mlue ½ / mlue = ½0,21 – 0,210 ½/ 0,210 = 0,0
La valeur déterminée expérimentalement correspond bien à celle lue sur l'étiquette.
Il est rare de trouver une erreur relative nulle, les différentes erreurs expérimentales se sont compensées.
Annexe 3 ( à rendre avec la copie)
©Sciences Mont Blanc