Correction Bac Liban - Juin 2006 - Calculatrice autorisée
I ) La logan au banc d'essai (mécanique) - (électricité) (9 points)
II ) Teneur en CO2 d'un vin (3 points)
III ) pH d'un mélange (4 points)
I ) ( points) (spe)
Liban - Juin 2006 - I ) La logan au banc d'essai (mécanique) :
PARTIE A: Performances et comportement routier
I ) Mesures de reprises
1) a) a1 = dv / dt. La direction et la norme de ce vecteur sont constants. On a donc a1 = dv/dt
On intègre par rapport à t : v(t) = a1 . t + constante = a1 . t + v0
b) vA = a1 . tA – v0 ; a1 = (vA – v0 ) / tA = ((70 – 30).103 / 3600) / 5,4 = 2,058 » 2,1 m.s-2
2) a) On intègre à nouveau par rapport à t : x(t) = a1 . t2 / 2 + v0 . t + constante ( à t = 0 s, x = 0)
x(t) = a1 . t2 / 2 + v0 . t
b) D = a1 . tA2 / 2 + v0 . tA
D = 2,1 x 5,42 / 2 + (30.103 / 3600) x 5,4 = 75,62 » 76 m
 II ) Virage sur une trajectoire
circulaire
II ) Virage sur une trajectoire
circulaire
1) a) v3 = d / t = G2G4 / 2 t ; v5 = G4G6 / 2 t
b) La mesure G2G4 donne 2,2 cm,
G2G4 = 2,2 x 10 = 22 m
La mesure G4G6 donne aussi 2,2 cm,
G4G6 = G2G4 = 22 m
v3 = G2G4 / 2 t = 22 / (2 x 1,00) = 11 m.s-1
v3 = 11 x 3600 / 1000 » 40 km.h-1 = v5
c) Pour la direction de v3, on trace une parallèle à G2G4 passant par G3.
Pour la direction de v5, on trace une parallèle à G4G6 passant par G5 .
Pour tracer Dv4, on trace v5 à partir de G4 puis on place au bout, - v3 , la somme nous donne Dv4.
Dv4 mesure 2,5 cm, Dv4 » 5,0 m.s-1
2) a) a4 = Dv4 / 2 t.
b) a4 = 5,0 / (2 x 1,00) = 2,5 m.s-2
3) a) Cette accélération est centrifuge.
b) L'effet de cette accélération est négligeable devant celui de l'accélération de la pesanteur n'est pas négligeable car sa valeur est du même ordre de grandeur que celle de g.
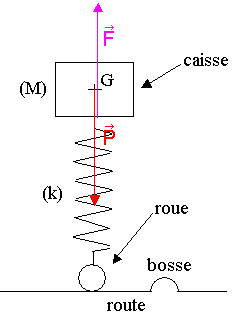 III ) Suspension
III ) Suspension
1) a) Les forces qui s'exercent sur la caisse sont :
* le poids P de la caisse exercée par la Terre, verticale vers le bas : P = M . g
* la force F exercée par le ressort, verticale vers le haut : F = k . ½Dl0½
b) La caisse est immobile dans le référentiel terrestre supposé galiléen, on peut donc lui appliquant le principe d'inertie : P + F = 0 . Les deux forces ont donc la même norme :
F = P ; k . ½Dl0½ = M . g
2) a) On a donc : k . (½Dl0½+ h ) = (M + m) . g = M . g + m . g = k . ½Dl0½+ m . g
On a donc : k . h = m . g ; k = m . g / h
b) [k] = [m . g / h] = M . L.T-2 / L = M . T-2 . k se mesure en kg.s-2 .
c) k = m . g / h = 280 x 9,8 / 3,0.10-2 = 9,1.104
kg.s-2
3) T0 = 2 p ![]() ( (M + m1)
/ k ) = 2 x 3,14 x
( (M + m1)
/ k ) = 2 x 3,14 x ![]() ((1095 +70) / 9,1.104)
= 0,71 s
((1095 +70) / 9,1.104)
= 0,71 s
4) a) Le régime observé est apériodique puisqu'il n'y a pas d'oscillations.
b) Ses amortisseurs étant «fatigués », on observe des oscillations autour de l position d'équilibre avant de l'atteindre, on a donc un régime pseudo-périodique.
5) a) Le phénomène observe par l'essayeur est la résonance.
b) La période des excitations doit égale à la période propre de l'oscillateur pour que ce phénomène ait lieu.
c) D = v . Dt = v . T0 = (80.103 / 3600) x 0,71 = 16 m
d) La résonance intervient à une certaine période correspond à la vitesse de 80 km.h-1 , pour l'éviter , on peut ralentir mais on pourrait aussi dépasser cette vitesse de 80 km.h-1 , on évite ainsi le maximum d'amplitude des oscillations.
Mais ceci est à éviter absolument car très dangereux !
©Sciences Mont Blanc
Liban - Juin 2006 - I ) La logan au banc d'essai (électricité) :
PARTIE B : « L'injecteur par rampe commune »
I ) Prévision d'un dipôle bobine-conducteur ohmique :
1) D'après la loi des tensions : E = uR0(t) + uL(t)
di / dt = 0 ; E = R0 . I0 + + r . I0 = (R0 + r).I0 ; I0 = E / (R + r)
2) uL(t) + uR0(t) = 0 ; L.di/dt + r.i + R0.i = 0 ; L.di/dt + (r + R0).i = 0
3) a) La bobine freine les variations brusques de l'intensité, au lieu de s'annuler instantanément, elle diminue progressivement jusqu'à s'annuler.

b) [t] = [L / (R0 + r)]
[L] = [u /(di/dt) ] = U.T.I-1
[R] = U / I
[t] = U.T.I-1 / (U.I-1) = T
t a la dimension d'un temps.
c) t = L / (R0 + r)
t = 0,94/(150+20) = 5,5.10-3 s
d) D'après le graphique,
i(t) = 0,013 A .
Cela correspond à ce qui est attendu, 37% I0 .
II ) Mesure des caractéristiques de la bobine de l'injecteur
1) D'après la figure 3, I0' = 0,035 A = I0 , on a donc r ' = r = 20 W .
2) a) D'après le graphique, la constante de temps t' est égale à 0,014 s.
b) L' = t ' . (R0 + r ' ) = 0,014 x (150 + 20 ) = 2,4 H

©Sciences Mont Blanc
Liban - Juin 2006 - II ) Teneur en CO2 d'un vin :
1) a) A1
max = 0,02 ; A2 max = 0,044 ; A3
max = 0,10 ; A4 max = 0,12 ; A5
max = 0,056 ;
b)

c) La courbe tracée est une droite passant par l'origine.
On peut donc en déduire que l'absorbance est proportionnelle à la concentration.
2) a) La courbe est une droite passant par l'origine, d'équation A = k . C où k est le coefficient directeur de la droite. Ceci est donc en accord avec la loi de Beer-Lambert.
b) D'après la courbe, k = 0,12 / 29,5.10-3 = 4,07 L.mol-1
k = ε . L ; ε = k / L = 4,07 / 3,5.10-3 = 1,16.103 L.mol-1m-1
3) a) On reporte la valeur A5 max sur la courbe pour déterminer C5 .
D'après le tracé sur la courbe, la concentration C5 est proche de 14 mmol.L-1 .
b) Soit t5 la concentration massique du vin :
t5 = C5 . M(CO2) = 14.10-3 x (12 + 2 x 16) = 0,62 g.L-1 = 620 mg.L-1
Le vin entre donc dans la catégorie des vins cités.
©Sciences Mont Blanc
Liban - Juin 2006 - III ) pH d'un mélange:
I ) Étude de deux solutions
1) a) Equation : HNO2(aq) + H2O(l) = H3O+(aq) + NO2(aq)-
constante d’équilibre : Ka1 = [H3O+]éq . [NO2-]éq / [HNO2]éq
b) Equation : HCOO–(aq) + H2O(l) = HO-(aq) + HCOOH(aq)
constante d’équilibre K = [HO-]éq . [HCOOH]éq / [HCOO-]éq
2) a)

b) Dans la solution d'acide nitreux, pH < pKa1 , la forme acide HNO2 est donc prédominante.
Dans la solution de méthanoate de sodium, pH > pKa2 , la forme basique HCOO- est donc prédominante.
II ) Étude d'un mélange de ces solutions
1) a) Equation : HNO2 (aq) + HCOO-(aq) = NO2- (aq) + HCOOH(aq)
b) quotient de réaction : Qr,i = [NO2-]i . [HCOOH]i / ([HNO2]i . [HCOO-]i )
On peut considérer que les quantités initiales de NO2- et HCOOH sont nulles.
Qr, i est donc quasi nul.
c) Qr,éq = [NO2-]éq . [HCOOH]éq / ([HNO2]éq . [HCOO-]éq )
Qr,éq = [NO2-]éq . [H3O+]éq .[HCOOH]éq / ([HNO2]éq . [H3O+]éq . [HCOO-]éq )
Qr, éq = Ka1 / Ka2 = 10-3,3 + 3,8 = 100,5 = 3,2
d) Qr , i < Qr éq , la réaction évolue donc dans le sens direct de l'équation, de la formation de NO2- et HCOOH.
2) a) Tableau d'avancement de la transformation entre l'acide nitreux et le méthanoate de sodium
|
Équation |
HNO2 (aq) + HCOO-(aq) = NO2- (aq) + HCOOH(aq) |
||||
|
État du système chimique |
Avance-ment (mol) |
Quantités de matière (mol) |
|||
|
n(HNO2(aq)) |
n(HCOO–(aq)) |
n(NO2(aq)-) |
n(HCOOH(aq)) |
||
|
État initial |
x = 0 |
n1 |
n2 |
0 |
0 |
|
État intermédiaire |
x |
n1 - x |
n2 - x |
x |
x |
|
État d’équilibre |
x = xéq |
n1 - xéq |
n2 - xéq |
xéq |
xéq |
b) [HNO2]éq = n(HNO2)éq / VT = (n1 – xéq) / VT = (4,0 – 3,3).10-2 / 0,400 = 1,75.10-2 mol.L-1
[HCOO-]éq = n(HCOO-)éq / VT = (n2 – xéq) / VT = (8,0 – 3,3).10-2 / 0,400 = 1,2.10-1 mol.L-1
[NO2-]éq = [HCOOH]éq = xéq / VT = 3,3.10-2 / 0,400 = 8,25.10-2 mol.L-1
c) Qr, éq = [NO2-]éq . [HCOOH]éq / ([HNO2]éq . [HCOO-]éq ) = (8,25.10-2)2 / (1,75.10-2 x 1,2.10-1)
Qr, éq = 3,3
Cette valeur est très proche de celle obtenue à la question 1. c).
3) Ka1 = [H3O+]éq . [NO2-]éq / [HNO2]éq ;
[H3O+ ]éq = Ka1 . [HNO2]éq / [NO2-]éq = 10-3,3 x 1,75.10-2 / 8,25.10-2 = 1,1.10-4 mol.L-1
pH3 = - log [H3O+]éq = 4,0
©Sciences Mont Blanc
Liban - Juin 2006 - I ) (spe) :
©Sciences Mont Blanc