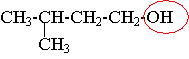Correction Bac Polynésie Juin 2006
I ) Résistance d'une bobine réelle
II ) Où il est question de la lumière (diffraction)
- (cinétique)
III ) Purification du cuivre : principe du raffinage du cuivre
Polynésie Juin 2006 - I ) Résistance d'une
bobine réelle :
A ) En régime permanent :
1)
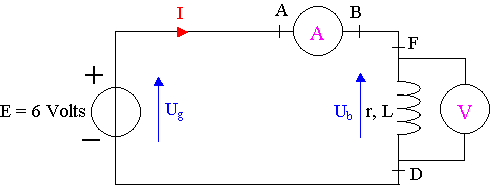
2) En régime permanent, dIb /dt = 0 ; Ub = r1 . Ib
r1 = Ub / Ib = 5,95 / 410.10-3 = 14,5 W
B ) En régime transitoire :
1) Le phénomène observé dans le circuit est l'établissement du courant.
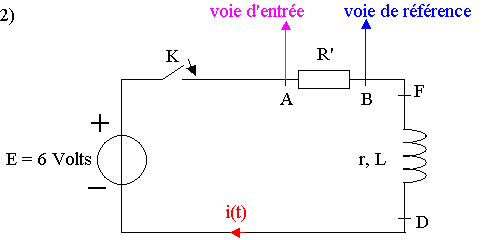
Pour obtenir une tension proportionnelle à l'intensité du
courant dans le circuit, il faut mesurer la tension aux bornes de la résistance (UR' = R'.i ).
3)
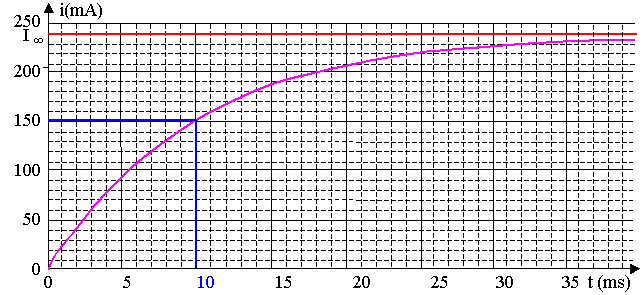
Pour déterminer t, on peut utiliser la méthode des 63 %, i(t) = 0,63 . I ¥ = 151 mA.
On peut aussi utiliser la méthode de la tangente à l'origine qui coupe l'asymptote (i = I ¥) à t = t, mais cette 2ème méthode est moins précise à cause du tracé de la tangente.
D'après le graphique, t = 10 ms.
4.1) t = L / (R' + r)
[t] = [L] / [R] ; [L] = [Ub / (di/dt)] = U.I-1.T ; [R] = [U / i ] = U.I-1
[t] = ( U.I-1.T ) / ( U.I-1 ) = T ; t est bien homogène à un temps.
4.2) R' + r2 = L / t ; r2 = L / t - R' = 250.10-3 / 10.10-3 – 10,0 = 15 W
5.1) Le régime au delà de 5 t est le régime permanent.
5.2) Ug = UR' + UL = R'.I ¥ + r.I ¥ = (R' + r).I ¥ ; R' + r = E / I ¥
r = E / I ¥ - R' ; r3 = 6,00 / 240.10-3 – 10,0 = 15 W
6) Les trois valeurs r obtenues dans les parties A et B sont bien cohérentes
entre elles , elles sont très proches.
C ) En régime oscillatoire
1) 1.1) T0 = 2 p ![]() (L.C).
(L.C).
1.2) T0 = 2 x 3,14 x ![]() (250.10-3 x
4.10-6 ) » 6,3
ms (Ce résultat devrait être avec
1 chiffre significatif à cause de la précision étrange de C mais cela devient
ridicule et gênant pour la question 2.3.)
(250.10-3 x
4.10-6 ) » 6,3
ms (Ce résultat devrait être avec
1 chiffre significatif à cause de la précision étrange de C mais cela devient
ridicule et gênant pour la question 2.3.)
2.1) Les oscillations sont amorties à cause de la résistance de la bobine
qui dissipe de l'énergie par effet joule.
2.2) T1 = kS . NS / 2 = 2 x 6,2 / 2 = 6,2 ms ; T2 = 6,4 ms.
La pseudo-période T est donc comprise entre 6,2 et 6,4 ms.
2.3) T est proche de T0 .
©Sciences Mont Blanc
Polynésie Juin 2006 - II ) Où il est question de la lumière (diffraction) :
PARTIE A
1) On observe la diffraction de la lumière ce qui prouve le caractère ondulatoire de la lumière.
2)
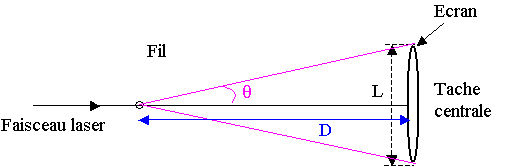
3) q étant petit, tan q = q ; q
= tan q
= (L / 2) / D = L / 2D
4) q = l / a. q en radian ; l et a en mètre.
5) q = l / a = L / 2D
; L = 2 l . D / a
6) La relation précédente indique que plus a est petit, plus l
est grand.
Dans la figure A, la largeur L est plus grande, elle correspond donc à a1 = 60 mm.
Dans la figure B, la largeur L est plus petite, elle correspond donc à a2 = 80 mm.
7) Une lumière monochromatique se compose d'une seule radiation lumineuse
d'une longueur d'onde l unique.
8) La courbe L = f(1/a) est une droite passant par l'origine d'équation :
L = k . (1/a) où k est le coefficient directeur de la droite.
L est proportionnelle à 1/a . Cela correspond à la relation de la question
5 avec k = 2 l . D
9) Pour déterminer le coefficient directeur k, de la droite, on utilise 2
points, l'origine O (0, 0) et un 2ème point A ( 25000 ; 0,0678).
k = LA / (1/aA) = 0,0678 / 25000 = 2,71.10-6
USI
l = k / 2D = 2,71.10-6 / (2 x 2,50) = 5,42.10-7 m = 542 nm
10) c = l / T = l . f ;
f = c / l = 3,00.108 / 542.10-9
= 5,53.1014 Hz
11) La fréquence et la couleur associées à cette radiation ne varient pas
mais la longueur d'onde est modifiée à la traversée de ce milieu transparent
dispersif.
©Sciences Mont Blanc
Polynésie Juin 2006 - II ) Où il est question de la lumière (cinétique) :
PARTIE B
1.1) On peut considérer que l'absorbance est-elle significative entre 500 et 575 nm, elle est maximale entre 520 et 560 nm.
La solution est violette à cause des ions permanganate.
1.2) Un laser de longueur d'onde 540 nm est bien adapté pour l'étude spectrophotométrique
de la transformation car l'absorbance est maximale à cette longueur d'onde.
2.1) L'absorbance est proportionnelle à la concentration en ions permanganate
, or ces ions sont consommés par la réaction au cours du temps, elle diminue
donc.
2.2) n1 = n(MnO4-)0 = [MnO4-]
. V1 = 5,0.10-4 x 1,0.10-3
= 5,0.10-7 mol
n2 = n(H2C2O4 )0 = [H2C2O4] . V2 = 12,5.10-4 x 1,0.10-3 = 1,25.10-6 mol
2.3)
|
Equation chimique |
2 MnO4-(aq)+ 5 H2C2O4(aq)+ 6 H3O+(aq) = 2 Mn2+(aq) + 10 CO2(aq) + 14 H2O(l) |
||||||
|
Etat |
Avanc. |
Quantité de matière en mol |
|||||
|
initial |
0 |
n1 |
n2 |
excès |
0 |
0 |
excès |
|
en cours |
x |
n1 – 2 x |
n2 – 5 x |
excès |
2 x |
10 x |
excès |
|
final |
xmax |
n1 – 2 xmax |
n2 – 5 xmax |
excès |
2 xmax |
10 xmax |
excès |
Pour déterminer xmax , on utilise l'hypothèse d'une réaction totale.
Si MnO4- est limitant, n1 – 2 xmax = 0 ; xmax = n1 / 2 = 2,5.10-7 mol
Si H2C2O4 est limitant, n2 – 5 xmax = 0 ; xmax = n2 / 5 = 2,5.10-7 mol
Les réactifs sont donc dans les proportions stoechiométriques et sont tous les deux limitants et xmax = 2,5.10-7 mol
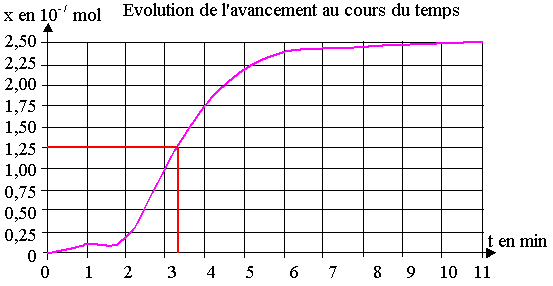
Cette valeur correspond bien à la valeur maximale de x dans le graphe de la figure 7.
2.4) a) Pour évaluer la vitesse volumique à une date t, on trace la tangente
en ce point et on détermine le coefficient directeur qui correspond à la valeur
de dx/dt à ce temps, on divise ensuite par Vmel pour calculer v(t).
b) En suivant la pente de la tangente, on en déduit l'évolution de la vitesse.
La vitesse est faible au début , puis elle augmente vers 2 min , reste presque constante
jusqu'à 5 min et elle diminue jusqu'à s'annuler.
Le début est inhabituel car la vitesse est souvent maximale au début à cause du facteur cinétique de la concentration des réactifs mais cette réaction est particulière car elle est autocatalytique, elle produit son propre catalyseur, les ions Mn2+ .
2.5) Le temps de demi réaction t1/2. est le temps au bout duquel
x = xmax / 2 = 1,25.10-7 mol
2.6) D'après le graphe, t1/2 » 3,3
min
©Sciences Mont Blanc
Polynésie Juin 2006 - III ) Hydrolyse d'un ester :
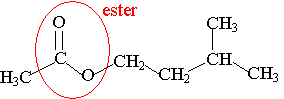
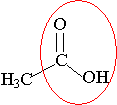
1) L'éthanoate de 3-méthylbutyle est un ester.
2) CH3-CO-O-CH2-CH2-CH(CH3)2 + H2O = CH3-CO-OH + (CH3)2CH-CH2-CH2-OH
3) acide éthanoïque + 3-méthylbutan-1-ol
|
L'acide éthanoïque est un acide carboxylique. |
Le 3-méthylbutan-1-ol est un alcool |
4.1) CH3-COOH(aq) + HO-(aq) ® CH3-COO-(aq)
+ H2O(l)
Une réaction de dosage est totale, on peut utiliser une flèche ® pour la symboliser.
4.2) K = [CH3COO-]éq / ([HO-]éq
. [CH3COOH]éq)
K = ([CH3COO-]éq.[H3O+ ]éq) / ([CH3COOH]éq.[HO-]éq.[H3O+]éq) = KA / Ke
K = 1,8.10-5 / 1,0.10-14 = 1,8.109
On peut donc la considérer comme totale.
4.3.1) L'équivalence d'une réaction de titrage est le moment où les réactifs
ont été mélangés dans les proportions stoechiométriques de l'équation.
4.3.2) D'après l'équation, à l'équivalence, nA = nB E
= CB . VB E
4.3.3) Il y a 10 béchers : n = 10
nA = 10 CB . VB E
5.1) La réaction d'hydrolyse d'un ester est une réaction lente et limitée
par la réaction inverse d'estérification.
5.2) n0 ester = m0 / Mester =
rester . Vester / Mester = 0,87 x
15 / 130 = 0,10 mol
n0 eau = meau / Meau = reau . Veau / Meau = 1,0 x 35 / 18,0 = 1,9 mol
5.3)
|
Equation chimique |
ester + eau = acide + alcool |
||||
|
Etat du système |
Avancement |
Quantité de matière (mol) |
|||
|
Etat initial |
x = 0 mol |
0,10 |
1,9 |
0 |
0 |
|
Etat intermédiaire |
x (mol) |
0,10 – x |
1,9 – x |
x |
x |
|
Etat final |
xf (mol) |
0,10 - xf |
1,9 – xf |
xf |
xf |
6.1) D'après la courbe de la figure 3, à la date t = 120 min, n est voisin
de 0,085 mol.
nacide = xf = 0,085 mol
D'après l'équation et les quantités initiales des réactifs, l'ester est le réactif limitant.
Si la réaction était totale, la quantité finale d'ester serait nulle, 0,10 – xmax = 0 , xmax = 0,10 mol.
Taux d'avancement final : t1 = xf / xmax = 0,085 / 0,10 = 0,85 = 85 %
6.2) On peut augmenter le taux d'avancement final de la réaction d'hydrolyse
de l'éthanoate de 3-méthylbutyte en éliminant un des produits formés au fur
et à mesure de sa formation si cela est possible. On peut aussi réaliser une
hydrolyse basique en remplaçant l'eau par des ions hydrolyde HO-
, on forme alors la base conjuguée de l'acide au lieu de l'acide et on évite
la réaction inverse, l'estérification.
©Sciences Mont Blanc
Polynésie Juin 2006 - III ) Purification
du cuivre : principe du raffinage du cuivre (spe):
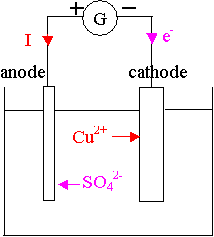 Première partie :
Première partie :
1) Le courant sort du pôle + du générateur, les électrons circulent en sens inverse.
Les cations sont attirés par l'électrode négative, où arrivent les électrons.
Les anions sont attirés par l'électrode positive.
L'anode est l'électrode où se produit l'oxydation :
Cu(s) = Cu2+(aq) + 2 e-
La cathode est l'électrode où se produit la réduction :
Cu2+(aq + 2 e- = Cu(s)
2) La transformation qui se produit lors d'une électrolyse est forcée car
on impose une tension électrique au système chimique, on lui apporte de l'énergie
pour qu'il évolue.
3) A l'anode : Oxydation :
Cu(s) = Cu2+(aq) + 2 e-
A la cathode : Réduction : Cu2+(aq + 2 e- = Cu(s)
4) Equation globale : Cu2+(aq
+ Cu(s)- = Cu(s) + Cu2+(aq)
5) Cette électrolyse est à « anode soluble » car cette électrode est en métal
cuivre qui est consommée au cours de l'électrolyse.
6) La concentration en ions cuivre II de la solution électrolytique ne varie
pas au cours de l'électrolyse car l'équation indique que la consommation d'un
ion Cu2+ est compensée par la formation d'un ion Cu2+ .
7) On ajoute de l'acide sulfurique dans la solution électrolytique pour que
le pH soit inférieur à 5, ce qui évite la formation de Cu(OH)2
à la place des ions Cu2+ dont on a besoin pour l'électrolyse.
Deuxième partie :
1) La plaque d'acier doit jouer le rôle de la cathode car pour obtenir un dépôt de cuivre, il faut une réduction des ions Cu2+ .
2) Q = I . Dt
3) Q = ne . NA . e = I . Dt ; ne
= (I . Dt) / (NA.e)
4) Réduction : Cu2+(aq) + 2 e- =
Cu(s) . ne
= 2 nCu
5) nCu = ne / 2 = (I . Dt) /
(2 NA.e) ; mCu
= nCu . MCu = (I . Dt . MCu ) / (2
NA.e)
mCu = 400.10-3 x 30,0 x 60 x 63,5 / ( 2 x 6,02.1023 x 1,60.10-19 ) = 0,237 g = 237 mg
6) écart = ½mCu - ½Dm½½ / mCu = (0,241
– 0,237) / 0,237 = 0,17 = 17 %
Il peut y avoir plusieurs explications possibles à cet écart : variation de l'intensité du courant, électrode mal séchée, imprécision de la pesée, présence d'impuretés.
©Sciences Mont Blanc