Correction Bac Amérique du Sud Novembre 2007
I ) Etude de satellites d'observation (5 points)
II ) Cinétique chimique et lumière (7 points)
III ) Transformations spontanées ou
forcées (4 points)
IV) Corrosion et protection des métaux (spe)
(4 points)
Correction Bac Amérique du Sud Nov 2007 - I ) Etude
de satellites d'observation :
©Sciences Mont Blanc
Correction Bac Amérique du Sud Nov 2007 -
II ) Cinétique chimique et lumière :
©Sciences Mont Blanc
Correction Bac Amérique du Sud Nov 2007 - III ) Transformations spontanées ou forcées
:
1) Réaction entre le cuivre métal et le dibrome en solution aqueuse.
1.1) Qr, i = [Cu2+]i .[Br-]i 2 / [Br2]i = 0 x 0 / 1,0.10-2 = 0
1.2) Qr, i < K1 . D’après le critère d’évolution spontanée, le système évolue dans le sens direct, dans le sens de formation de Cu2+ et Br- .
Ceci est confirmée par les observations.
1.3) La transformation est spontanée, elle s’effectue sans apport d’énergie.
2) La solution aqueuse de bromure de cuivre (II).
2.1) Qr, i = [Br2]i / ([Cu2+]i .[Br-]i 2 ) = 0 / (0,50 x 1,02 ) = 0
2.2) Qr, equil = K2 = 8,3.10-26.
2.3) Qr, i » K2 . Le système est donc au départ à l’équilibre, le système n’évolue pas, les concentrations ne changent pas, la solution aqueuse de bromure de cuivre (II) est stable.
3) Électrolyse de la solution aqueuse de bromure de cuivre
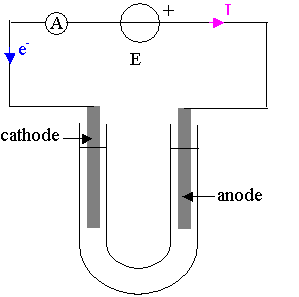 3.1.1) Les électrons circulent
en sens inverse du courant et partent de la borne négative du générateur et
arrivent
3.1.1) Les électrons circulent
en sens inverse du courant et partent de la borne négative du générateur et
arrivent
à la cathode où a lieu une réduction d’un oxydant .
L’anode est l’autre électrode reliée à la borne positive du générateur,
où a lieu l’oxydation d’un réducteur
3.1.2) A l'anode, il y a une oxydation : 2 Br-(aq) = Br2 (aq) + 2 e-
3.1.3) A la cathode, il y a une réduction : Cu2+(aq) + 2 e- = Cu(s)
3.1.4) équation d’électrolyse : Cu2+(aq) + 2 Br-(aq) = Cu(s) + Br2 (aq)
3.1.5) La réaction d'électrolyse est forcée.
3.2) Etude quantitative
3.2.1) Q = I x t = 1,00 x 60 x 60 = 3 600 C
3.2.2) Q = n(e- ) x F ; n(e-) = Q / F = 3 600 / 96 500 = 0,040 mol
3.2.3) D’après la demi-équation : Cu2+(aq) + 2 e- = Cu(s) , n(Cu) = n(e- ) / 2 = 0,020 mol
3.2.4) m(Cu) = n x M = 0,020 x 63,5 = 1,27 g
©Sciences Mont Blanc
Correction Bac Amérique du Sud Nov 2007
- IV ) Corrosion et protection des métaux (spe):
©Sciences Mont Blanc