Correction Bac Afrique Juin 2008
Calculatrice autorisée
I ) Autour de la voiture (A - ultrasons) - (B - acide) (7 points)
II ) Pluton et Charon (satellite) (5 points)
III ) La bouteille magique (oxydo-réduction)
(4 points)
III )(spe) De l'eugénol à la vanilline
(4 points)
Correction Bac Afrique Juin 2008 - I ) Autour de la voiture - Partie A - ultrasons :
Partie A : Le stationnement « ultra-simple» avec les ultrasons
1) Généralités sur les ondes sonores
1.1) On appelle onde mécanique progressive le phénomène de propagation d'une perturbation dans un milieu matériel sans transport de matière.
1.2) Une onde mécanique a besoin d'un support matériel pour se propager. Le son ne se propage pas dans vide présent entre la Terre et la Lune.
1.3) La lumière est une onde électromagnétique qui se propage dans le vide.
1.4) La direction de la perturbation est parallèle à celle de la direction de la propagation, l'onde sonore est donc longitudinale.
|
2.1) |
 |
|
2.2) |
 |
|
2.3) Les signaux des fenêtres 1 et 2 sont identiques et en phase car ils sont à la même distance de l'émetteur. |
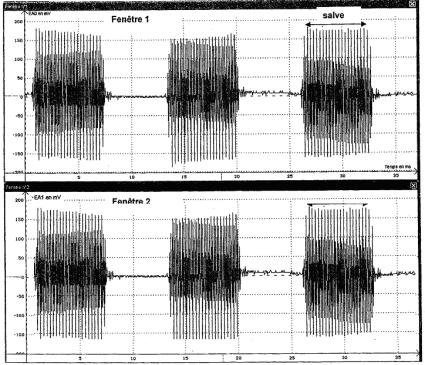 |
|
2.4) Un carreau mesure 1,3 cm, Δt mesure 1,1 cm Δt = (1,1 / 1,3) x 1,0 = 0,85 ms
2.5) V1 = d / Δt = 0,3 / 0,85.10-3 = 3,5.102 m.s-1 La précision des mesures est ici très mauvaise. Un seul chiffre significatif pour la mesure de d est insuffisant. Cette valeur est assez proche de la valeur réelle de 340 m.s-1 .
2.6) La célérité du son dépend du milieu de propagation, elle est plus grande dans l'eau. |
 |

3.1) On mesure un maximum de périodes (3) pour obtenir une meilleure précision.
D'après la figure 3, 3 T vaut 7,5 divisions.
T = 7,5 x 10 / 3 = 25 μs = 2,5.10-5 s
f = 1 / T = 1 / 2,5.10-5 = 4,0.104 Hz
3.2) Les courbes sont en phase à chaque fois que l'on décale le récepteur d'une distance d'une longueur d'onde λ.
10 λ = 8,4 cm ; λ = 8,4.10-3 m = 8,4 mm
3.3) V2 = λ / T = 8,4.10-3 / 2,5.10-5 = 3,4.102 m.s-1
Cette valeur correspond bien à la réalité.

3.2) 4 λ = 3,36 cm ; 5 λ = 4,2 cm
La distance d2 est comprise entre 4 λ et 5 λ.
Si on décale les récepteurs de 4 λ, les signaux sont en phase.
En reculant plus, jusqu'à la distance d2, le signal se décale d'un temps Δt2 mis
pour parcourir la distance d2 - 4 λ.
D'après les figures 3 et 4, Δt2 = 1,3 x 10 = 13 μs.
V2 = (d2 – 4 λ)/ Δt2 ; d2 = 4 λ + V2 . Δt2
d2 = 4 x 8,4.10-3 + 3,5.102 x 13.10-6 = 3,8.10-2 m = 3,8 cm
4) La distance parcourue par le son est un aller-retour, soit deux fois la distance de l'obstacle d.
2 d = v . t
v = 1,2.103 km.h-1 = 1,2.103 x 1000 / 3600 = 333 m.s-1
d = v . t / 2 = 333 x 9,0.10-3 / 2 = 1,5 m
©Sciences Mont Blanc
Correction Bac Afrique Juin 2008 - I ) Autour de la voiture - Partie B - acide :
Partie B : L'électrolyte utilisé dans la batterie
1) Pour diluer 1000 fois, il faut un rapport de volumes de 1000 entre le volume de la fiole jaugée et celui de la pipette graduée.On choisit donc une fiole de 1,00 L ; une pipette jaugée de 1,00 mL, et un bécher de 50 mL.
2) [H3O+]S1 = 10-pH = 10-2,13 = 7,41.10-3 mol.L-1
3) Lors d'une dilution, la quantité de matière ne change pas, on ne fait que rajouter de l'eau :
[H3O+]S0 . V0 = [H3O+]S1 . V1 ; [H3O+]S0 = [H3O+]S1 . V1 / V0 = 1000 [H3O+]S1 = 7,41 mol.L-1
4.1) tableau d'avancement :
|
Equation chimique |
H2SO4 (l) + 2 H2O (l) = 2 H3O+(aq) + SO42-(aq) |
||||
|
Etat du système |
Avancement (mol) |
Quantités de matière (mol) |
|||
|
Etat initial |
0 |
ni (H2SO4) |
excès |
0 |
0 |
|
Etat intermédiaire |
x |
ni (H2SO4) - x |
excès |
2 x |
x |
|
Etat final |
xmax |
ni (H2SO4) - xmax |
excès |
2 xmax |
xmax |
4.2) D'après le tableau d'avancement, nf(H3O+) = 2 xmax
4.3) H2SO4 est le réactif limitant car l'eau est en excès. nf (H2SO4) = 0 = ni (H2SO4) – xmax
xmax = ni (H2SO4) ; nf(H3O+) = 2 xmax = 2 ni (H2SO4)
4.4) nf(H3O+) = [H3O+]f . V ; ni (H2SO4) = c . V
nf(H3O+) = 2 ni (H2SO4) ; [H3O+]f . V = 2 c . V ; c = [H3O+]f / 2 = 7,41 / 2 = 3,71 mol.L-1.
©Sciences Mont Blanc
Correction Bac Afrique Juin 2008 - II ) Pluton et Charon (satellite) :
1) Généralités
1.1 ) Un mouvement circulaire uniforme est un mouvement dont
la trajectoire est un cercle et où la norme du vecteur vitesse 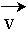 est constante.
est constante.

1.2) Il faut que le système soit soumis à une seule force constante perpendiculaire à son vecteur vitesse.
(ou le vecteur accélération  doit être centripète et constant)
doit être centripète et constant)
1.3)  A → B = - (G . MA.MB / d2
) .
A → B = - (G . MA.MB / d2
) .
2) Etude du système Pluton - Charon
 2.1) La période de révolution de Pluton est le temps que met Pluton pour effectuer
un tour autour du Soleil.
2.1) La période de révolution de Pluton est le temps que met Pluton pour effectuer
un tour autour du Soleil.
T = 248 années sidérales
2.2.1) On applique la 2ème loi de Newton au centre d’inertie de Charon dans le référentiel plutonocentrique :
 P → C = MC .
P → C = MC .  ;
;  P → C = (G . MP1.MC / R2
) .
P → C = (G . MP1.MC / R2
) . 
 =
(G . MP1 / R2) .
=
(G . MP1 / R2) .  ;
;  a la direction CP de C vers P. a = G . MP1 / R2
a la direction CP de C vers P. a = G . MP1 / R2
2.2.2) Dans le repère de Frenet :  = (dv/dt) .
= (dv/dt) .  +
(v2 / R ) .
+
(v2 / R ) . 
(dv/dt) .  +
(v2 / R ) .
+
(v2 / R ) .  = (G . MP1 / R2) .
= (G . MP1 / R2) . 
dv / dt = 0 ; la vitesse v est donc constante.
v2 / R =
G . MP1 / R2 ;
v2 = G . MP1 / R
; v =  (G . MP1
/ R )
(G . MP1
/ R )
2.2.3) v = (2 π R ) / T ; T =
2 π
R / v = 2 π
 (R3 / (G.MP1))
(R3 / (G.MP1))
2.2.4) T2 = 4 π2 . R3 / (G.MP1) ; T2 / R3 = 4 π2 / (G.MP1)
2.3.1) En connaissant la période T de révolution de Charon et la distance R entre Pluton et Charon, on peut en déduire la masse de Pluton MP1en utilisant l'égalité précédente.
2.3.2) MP1= 4 π2 R3 / (G.T2) = 4 x (3,14)2 x (1,94.107)3 /(6,673.10-11 x (5,518.105)2) = 1,42.1022 kg
2.3.3) MP1= 4 π2 R3 / (G.T2) – MC = 1,42.1022 – 1,61.1021 = 1,26.1022 kg
2.3.4) MP / MC = 1,31.1022 / 1,61.1021 = 8,14.
Ce rapport n'est pas assez grand pour pouvoir négliger MC devant MP.
La valeur de 1,31.1022 est proche de 1,26.1022 . L'hypothèse de la question 2.3.3) est donc valable.
©Sciences Mont Blanc
Correction Bac Afrique Juin 2008 - III ) La bouteille
magique (oxydo-réduction) :

1) Equation de la réaction modélisant la transformation chimique entre le glucose et la solution de bleu de méthylène.
1.1) Un oxydant est une espèce qui capte un ou plusieurs électrons.
Un réducteur est une espèce qui cède un ou plusieurs électrons.
1.2) BM+(aq) + 2 e- + H+(aq) = BMH(aq)
1.3) RCOOH(aq). + 2 e- + 2 H+(aq) = RCHO(aq) + H2O(l)
1.4) L'oxydation et la réduction mettent en jeu 2 électrons, on ajoute donc simplement les 2 demi-équations :
RCHO(aq) + BM+(aq) + H2O(l) + H+(aq) = RCOOH(aq) + BMH(aq) + 2 H+(aq)
Ce qui se simplifie : RCHO(aq) + BM+(aq) + H2O(l) = RCOOH(aq) + BMH(aq) + H+(aq)
2) Interprétation des observations
2.1) La transformation (1) provoque la formation de BMH incolore et la disparition de BM+ bleue, la solution se décolore.
En agitant, on dissout O2 qui réagit vite avec BMH pour former BM+ bleue, la solution se colore à nouveau.
En laissant reposer, la transformation (1) provoque la formation de BMH incolore et la disparition de BM+ bleue, la solution se décolore et ainsi de suite
2.2) Pour augmenter la vitesse de la réaction (1), on peut utiliser un catalyseur, augmenter la température ou augmenter la concentration en BM+.
3) Etude quantitative
|
Equation chimique |
2 BMH(aq) + O2 (aq) + 2H+(aq) = 2 H2O(l)+ 2 BM+(aq) |
|||||
|
Etat du système |
Avanc. |
Quantités de matière |
||||
|
Etat initial |
0 |
ni (BMH) |
ni (O2) |
excès |
excès |
0 |
|
Etat intermédiaire |
x |
ni (BMH) - 2x |
ni (O2) - x |
excès |
excès |
2 x |
|
Etat final |
xmax |
ni (BMH) - 2xmax |
ni (O2) - xmax |
excès |
excès |
2 xmax |
3.2) ni(O2) = V / Vm = 48.10-3 / 24,0 = 2,0.10-3 mol
3.3) Dans ce cas précis, les deux réactifs sont limitants, nf (O2) = 0. xmax = ni(O2) = 2,0.10-3 mol
nf (BMH) = 0 = ni (BMH) - 2xmax ; ni (BMH) = 2xmax = 4,0.10-3 mol
n(BM+)f = 2xmax = 4,0.10-3 mol
3.4) D'après ce qui précède , ni(BM+) = 4,0.10-3 mol
|
Equation chimique |
RCHO(aq) + BM+(aq) + H2O(l) = RCOOH(aq)+ BMH(aq)+ H+(aq) |
||||||
|
Etat final |
xmax |
ni(RCHO) - xmax |
ni(BM+ ) - xmax |
excès |
xmax |
xmax |
excès |
ni(RCHO) = m / M = 5,0 / 180 = 2,8.10-2 mol. Il est donc en excès par rapport à BM+.
BM+ est le réactif limitant : ni(BM+ ) - xmax = 0 ; xmax = ni(BM+ ) = 4,0.10-3 mol
n(RCHO)réagi = xmax = 4,0.10-3 mol
3.5) m(RCHO)reagi = n . M = 4,0.10-3 x 180 = 0,72 g ; m(RCHO)restant = 5,0 – 0,72 = 4,3 g
©Sciences Mont Blanc
Correction Bac Afrique Juin 2008 - III ) De l'eugénol
à la vanilline :(spe)

1) Extraction de l’huile essentielle du clou de girofle
 1.1) Le montage d’hydrodistillation
correspond au montage b auquel il faudrait ajouter un chauffe-ballon sur élévateur.
1.1) Le montage d’hydrodistillation
correspond au montage b auquel il faudrait ajouter un chauffe-ballon sur élévateur.
1.2.1) Le dichlorométhane est peu soluble dans l'eau, il ne se mélange pas et forme la phase organique qui contient aussi l'eugénol (peu soluble dans l'eau). La phase aqueuse contient surtout de l'eau et les ions sodium et chlorure.
1.2.2) La phase aqueuse contient surtout de l'eau et la phase organique contient surtout du dichlorométhane.
Le dichlorométhane est plus dense que l'eau, il coule dans l'eau. La phase inférieure est donc la phase organique.
1.2.3) L'eugénol est peu soluble dans l'eau et très soluble dans le dichlorométhane, il est donc dans la phase organique.
1.2.4) On ajoute du chlorure de sodium dans l’ampoule à décanter pour diminuer la solubilité de l'eugénol dans l'eau, pour en récupérer plus dans la phase organique.

1.2.5) Le cyclohexane peut être utilisé pour l'extraction mais la phase inférieure serait la phase aqueuse.
L'éthanol ne peut pas être utilisé car il est soluble dans l'eau et il n'y aurait qu'une seule phase.
1.3.1) L’huile essentielle extraite des feuilles de giroflier ne contient pas d'éthanoate d’eugényle car le chromatogramme ne montre pas de tache au même niveau pour le dépôt A (l’éthanoate d’eugényle) et pour le dépôt F (extrait).
1.3.2) Dans l’huile essentielle de clous de girofle, on peut identifier la présence de l'eugénol et de l'éthanoate d'eugényle car le chromatogramme montre des taches pour le dépôt H (extrait), au même niveau que le dépôt E (l’eugénol commercial) et que le dépôt A (éthanoate d'eugényle).
2) Sur le chemin de la vanilline
2.1.1) Le rôle du chauffage à reflux est de chauffer à pression ambiante (récipient ouvert) sans perte d'espèces chimiques (les vapeurs crées sont condensées par le réfrigérant et retombent dans le ballon). Cela permet d'accélérer la réaction sans modifier la réaction.
2.1.2) On utilise un anhydride d’acide plutôt qu’un acide carboxylique pour éviter la formation de l'eau (obtenue avec un acide) et ainsi empêcher la réaction inverse, l'hydrolyse de l'ester. Ainsi la réaction est rapide et totale.
2.1.3) On verse le contenu du ballon dans de l’eau glacée pour cristalliser l'éthanoate d'isoeugénol (il est insoluble dans l'eau glacée)
2.1.4) n(isoeugénol)0 = m / M = 5,0 / 164 = 3,0.10-2 mol
ρ = d . ρeau = 1,08 x 1,00 = 1,08 g.mL-1 ; n(anhydride) = m / M = ρ . V / M = 1,08 x 10 / 102 = 0,11 mol
2.1.5) On peut utiliser les notations suivantes pour les espèces chimiques :
isoeugénol : Is ; anhydride éthanoïque : An ; éthanoate d'isoeugénol : E ; acide éthanoïque : Ac
|
Equation chimique |
Is + An = E + Ac |
||||
|
Etat du système |
Avancement |
Quantité de matière en mol |
|||
|
Etat initial |
0 |
n(Is)0 |
n(An)0 |
0 |
0 |
|
Etat final |
xf |
n(Is)0 – xf |
n(An)0 - xf |
xf |
xf |
Pour connaître la masse maximale de E, on envisage la réaction est totale (hypothèse)
Si Is est limitant, n(Is)f = 0 = n(Is)0 – xmax ; xmax = n(Is)0 = 3,0.10-2 mol
Si An est limitant, n(An)f = 0 = n(An)0 – xmax ; xmax = n(An)0 = 0,11 mol
Is est donc limitant et xmax = 3,0.10-2 mol.
n(E)max = xmax = 3,0.10-2 mol ; m(E)max = n . M = 3,0.10-2 x 205 = 6,25 g
2.1.6) rendement : r = m / mmax = 5,6 / 6,25 = 0,90 = 90 % . La réaction est donc très avancée.
2.2.1) L'hydrolyse d'un ester est une réaction lente et limitée (et athermique).
2.2.2) Un catalyseur est une espèce chimique qui accélère la réaction sans la modifier.
©Sciences Mont Blanc