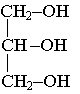Correction Bac Amérique du Nord Juin 2011
Calculatrice autorisée
I ) Hydrolyses des esters (6,5 points)
II ) Matière et antimatière (5,5 points)
III ) Constante de raideur d'un ressort
(4 points)
IV) Réalisation d'une modulation d'amplitude
(spe) (4 points)
Correction Bac Amérique du Nord Juin 2011 - I ) Hydrolyse
des esters :
1.1.1. )


1.1.2. ) Cette réaction est lente , équilibrée et donc limitée.
1.2.1. ) Le montage à reflux permet de chauffer et ainsi accélérer la réaction tout en évitant les pertes de vapeurs de produits.
Schéma du montage ci-contre :
1.2.2. ) L’acide sulfurique est un catalyseur de la réaction.
Il permet d’accélérer la réaction sans la modifier.
1.3.1. )
|
équation chimique |
ester
+ H2O = acide + alcool |
||||
|
État du système |
Avancement (mol) |
Quantités de matière (mol) |
|||
|
État initial |
0 |
n0 |
n0 |
0 |
0 |
|
En cours |
x |
n0 - x |
n0 - x |
x |
x |
|
État final |
xf |
n0 - xf |
n0 - xf |
xf |
xf |
Attention , ici , l’eau n’est pas un solvant, elle n’est pas en excès.
1.3.2. ) τ = xf / xmax
1.3.3. ) K = Qr, eq = ( [acide]eq x [alcool]eq ) / ( [ester]eq x [eau]eq ) = ( xf / V )2 / ( (n0 – xf) / V )2
K = xf2 / (n0 – xf )2 = xf2 / ( n02 x ( 1 – xf /n0)2)
Si la réaction était totale, n(ester)f = 0 = n0 – xmax ; xmax = n0 ; τ = xf / n0 ; K = τ2 / ( 1 - τ )2
1.3.4. ) K = τ2 / ( 1 - τ )2 = 1 / ( 1/τ -1 )2 ; ![]() K
= 1 / ( 1/τ -1 ) ; 1 /
K
= 1 / ( 1/τ -1 ) ; 1 / ![]() K
= 1/τ -1
K
= 1/τ -1
1/τ = 1 / ![]() K + 1
; τ = 1
/ (1 /
K + 1
; τ = 1
/ (1 / ![]() K + 1) =
1 / (1 /
K + 1) =
1 / (1 / ![]() 0,25 + 1) = 0,33
0,25 + 1) = 0,33
rendement η = nacide obtenu / nacide max = xf / xmax = τ = 0,33 = 33 %
1.4.) Si on extrait l’alcool du milieu réactionnel, l’équilibre est déplacé dans le sens direct de formation de l’acide et de l’alcool, la réaction inverse n’étant plus possible.
Le rendement η augmente.
2.1. )
|
équation chimique |
RCOOR’ + HO- =
RCOO- + R’OH |
|||
|
Quantités en
mol |
n0 -x |
n0 - x |
x |
x |
n(HO-)restant
= n(HO-)initial
- x
 2.2.2. ) x = n(HO-)initial
- n(HO-)restant ; x4 = 10.10-3
– 7,3.10-3 = 2,7.10-3 mol
2.2.2. ) x = n(HO-)initial
- n(HO-)restant ; x4 = 10.10-3
– 7,3.10-3 = 2,7.10-3 mol
x6 = 10.10-3 – 5,8.10-3 = 4,2.10-3 mol
2.2.3.) La réaction est totale, xf = xmax . L’ester est le réactif limitant.
n(ester)f = 0 = n0 – xmax ; xmax = n0
n0 = mester / Mester = 10,0 / 150 = 0,0667 mol ; xf = n0 = 0,0667 mol (avancement pour 200 mL )
Attention, le tableau
présente les valeurs de x pour 20 mL de solution, soit dix fois moins.
2.3.1. ) t ½ est le
temps au bout duquel
x = xmax
/ 2 = 0,0333 mol.
Pour comparer cette
valeur à celle du graphique, il faut la diviser par 10 car le dosage est réalisé
sur le dixième du volume de la solution .
x20 mL
(t ½ ) = 3,33.10-3 mol = 3,33 mmol
2.3.2. ) La vitesse de réaction est proportionnelle au coefficient directeur de la tangente à la courbe, celui-ci est maximal au départ , puis il diminue au cours du temps jusqu’à s’annuler.
La vitesse évolue donc de la même façon : elle est maximale au départ, elle diminue jusqu’à s’annuler.
2.3.3. ) En chauffant, la réaction est plus rapide. xmax n’est pas modifié.
La courbe violette du graphique correspond au cas où l’on chauffe.
3.1. )
|
glycérol
|
tributyrate
de glycéryle |
3.2. ) Le relargage permet de diminuer la solubilité du savon dans la phase aqueuse et donc de faciliter sa précipitation et sa séparation du reste du mélange.
©Sciences Mont Blanc
correction Bac Amérique du Nord Juin 2011
- II ) Matière et antimatière :
1. L’antimatière au voisinage de la Terre
1.1. Exploitation du texte :
1.1.1. E : énergie mise en jeu lors de la réaction en Joule ( J )
. m : différence entre la masse finale des noyaux produits et la masse
initiale des noyaux , en kilogramme (kg).
c : célérité de la lumière dans le vide en m.s-1 .
1.1.2. La relation précédente montre une équivalence entre la masse et
l’énergie. La phrase du texte suggère que lorsque matière et antimatière réagissent
, ils s’annihilent en convertissant la matière en énergie lumineuse.
1.2. Énergie créée lors de l’éruption solaire de juillet 2002 :
1.2.1. 0-1e + 0+1e
➔ 2 γ
1.2.2. E = Δm x c2 = ( 0 - m(0-1e) - m(0+1e) ) x c2 = - 2 x 9,109.0-31 x (2,998.108
)2 = -1,637.10-13 J
1.2.3. m(matière+antimatière) = 1 kg ; E = m x c2 = -
1 x (2,998.108 )2 = - 8,988.1016 J
Eéruption = - 8,988.1016
/ 3600 = - 2,497.1013 W.h = - 2,497.104
GW.h
Eéruption / Ejour = - 2,497.104 / - 1200
≈ 21.
Cela correspond à peu près à 21 fois la consommation journalière moyenne
d’énergie électrique française en 2006.
2. La création d’éléments radioactifs artificiels.
2.1. Étude de la réaction 1 :
2.1.1. Une particule alpha est un noyau d’hélium 42He
2.1.2. On utilise les lois de conservation de Soddy :
Conservation
du nombre de charge : 13 + 2 = Z + 15
; Z = 0.
Conservation du nombre de masse :
27 + 4 = A + 30 ; A = 1.
Le noyau formé est donc un neutron 10n .
Equation : 2713 Al + 42
He ➔ 3015 P + 10n (réaction 1)
2.1.3. ΔE = Δm x c2 = ( m(3015 P) + m(10n) – m(2713 Al ) - m(42 He) ) x c2
2.1.4. Δm = 29,970 1 + 1,008 66 - 26,974 4 - 4,001 50 = 2,86.10-3 u
Δm = 2,86.10-3 x 1,66043.10-27
= 4,75.10- 30 kg. ΔE = 4,75.10- 30 x (2,998.108)2 = 4,27.10-13
J
ΔE = 4,27.10-13 / 1,602.10-19
= 2,66.106 eV = 2,66 MeV
Cette réaction provoque un gain de masse. Δm > 0
2.2. Étude de la réaction 2 :
2.2.1. On utilise les lois de conservation de Soddy :
Conservation
du nombre de charge : 15 = Z
+ 14 ; Z
= 1.
Conservation du nombre de masse :
30 = A + 30 ; A
= 0.
Le noyau formé est donc un positon 10e .
Equation : 3015 P ➔ 3014 Si + 0+1e (réaction 2)
2.2.2. Cette réaction est spontanée. Elle se produit sans intervention
extérieure, sans apport énergétique. Elle libère de l’énergie. ( E < 0
). Elle provoque donc une perte de masse .
3. Décroissance radioactive du phosphore.
3.1. L’activité A(t) d’un échantillon radioactif est le nombre de désintégrations
par seconde.
A(t) = A0 x exp ( - λ x t ) avec A0 est l’activité initiale (à t
= 0s) en Becquerel,
λ est la constante
radioactive du noyau en s-1 ;
t : temps mesuré en seconde (s)
3.2. Le temps demi-vie t1/2 est la durée au bout de laquelle
la moitié des noyaux initialement présents a été désintégrée. N(t + t ½ )
= N(t) / 2 ou A(t + t ½ ) = A(t) / 2
A(t ½ ) = A0 / 2 = A0 exp ( - λ x t ½ ) ; ½ = exp ( - λ x t ½ ) ; ln ½ = - λ x t ½
ln 2 = λ x t ½
; t
½ = ln 2 / λ
3.3. A1 = A0 x exp ( - λ x t1 ) ; ln A1 / A0 = - λ x t1 = - ln 2 x t1
/ t ½
t1 = (t ½ / ln 2) x ln (A0 / A1) = (
156 / ln 2 ) x ln ( 7,2.1013 / 9,0.1012 ) = 468 s =
4,7.102 s
3.4. A0 / A1 = 7,2.1013 / 9,0.1012
= 72 / 9,0 = 8,0 = 23 ;
A(3 t ½ ) = A0 / 23
t1 = 3 t ½ = 3 x 156 = 468 s
©Sciences Mont Blanc
Correction Bac Amérique du Nord Juin 2011 - III ) Constante de raideur d'un ressort :
1. Étude statique
1.1. allongement : l0 = Le - L0
1.2. Le solide est immobile dans le référentiel terrestre
galiléen, on peut lui applique le principe d’inertie :  +
+  =
=  où
où  est
le poids du solide et
est
le poids du solide et  force exercée
par le ressort.
force exercée
par le ressort.
Le poids  est
vertical vers le bas . P
= m x g.
est
vertical vers le bas . P
= m x g.
La force du ressort
est vertical vers le haut car le ressort est étiré. F = k x l0
.
du ressort
est vertical vers le haut car le ressort est étiré. F = k x l0
.

On projète sur l’axe Ox : Px + Fx = 0 ; P – F = 0
P = F ; m
x g = k x l0
1.3. D’après le graphique, l0 est proportionnel à m.
l0 = a x m. avec a coefficient directeur de la droite.
On utilise deux points de la droite : O (0,0) et A(120,25).
a = (25.10-2
– 0 ) / ( 120.10-3 – 0 ) = 2,1 m.kg-1
D’après la question 1.2. , l0 = (g / k) x m = a x m
a = g /
k ; k = g / a = 9,8 / 2,1 = 4,7
N.m-1
2. Étude dynamique
2.1.1. T0 est la période propre des oscillations, temps pour faire une oscillation.
2.1.2. dx/dt = - (2 π / T0) Xm . sin (2 π t / T0 ) ; d2x/dt2 = - (2 π / T0)2 Xm . cos (2 π t / T0 )
m . d2x / dt2 + k . x = - m . (2 π / T0)2 Xm . cos (2 π t / T0 ) + k . Xm . cos(2 π t / T0 ) = 0
Xm.cos(2 π t / T0 ) . ( - m . (2 π / T0)2 + k ) = 0 ;
Xm ≠ 0 ; la fonction cosinus n’est pas toujours nulle , on a donc : ( - m . (2 π / T0)2 + k ) = 0
k = m . (2 π / T0)2 ;
 (
k / m ) = 2 π / T0 ;
(
k / m ) = 2 π / T0 ;  (
m / k ) = T0 / 2 π ; T0 = 2 π
(
m / k ) = T0 / 2 π ; T0 = 2 π
 ( m / k )
( m / k )
2.2.1. L’amplitude du mouvement diminue au cours du temps car les frottements font perdre de l’énergie à l’oscillateur.
2.2.2. La pseudo-période T est-elle très proche de T0 si l’amortissement est faible.

2.2.3. Pour que la mesure de T soit la plus précise possible, on mesure dix oscillations pour limiter l’erreur de mesure.
2.2.4. La courbe de la figure 2c est une droite.
Elle permet de calculer le coefficient de proportionnalité entre T02 et m. T02 = a2 . m
On utilise deux points de la droite : O (0,0) et A(100,0,80)
a2
= (0,80 – 0 ) / (100.10-3 – 0) = 8,0 s2.kg-1
D’après la question 2.1.2. , T02 = (4 π2 / k) . m
a2
= 4 π2 / k ; k
= 4 π2 / a2 = 4 x (3,14)2 / 8,0
= 4,9 N.m-1
Cette valeur est proche de celle calculée au 1.3..
©Sciences Mont Blanc
Correction Bac Amérique du Nord Juin 2011
- Spe - Réalisation d'une modulation d'amplitude (spe):
©Sciences Mont Blanc