Sujet Bac Antilles Septembre 2003
Calculatrice autorisée
I ) Espèces acides en solution (6,5 points)
II ) Défibrillateur cardiaque (5,5 points)
III ) L'âge de la Terre (4 points)
III ) (spe) Emission et réception d'une onde modulée en amplitude (4 points)
I ) Espèces acides en solution :
On se propose d’identifier deux espèces chimiques acides différentes notées
HA1 et HA2 , en utilisant quelques mesures mettant en
jeu différentes techniques expérimentales.
Tout d’abord, on prépare les deux solutions aqueuses S1 et S2, à partir des espèces HA1 et HA2 et d’eau distillée , de telle manière que la concentration en soluté apporté soit C0 = 1,0.10-2 mol.L-1 pour chacune d’elles. On considère que la réaction de chaque espèce acide dans l’eau est instantanée.
Les parties I, II et III sont indépendantes.
I ) Mesure par pH-métrie :
1) Nous allons tenter de différencier ces deux espèces acides en observant leur action sur l’eau, par l’intermédiaire d’une mesure de pH réalisée dans les m^mes conditions pour chaque solution.
a) Définir une espèce acide selon Brönsted.
b) Ecrire l’équation qui représente la réaction d’une espèce acide quelconque HA avec l’eau.
Indiquer les deux couples acide/base mise en jeu à cette occasion.
c) On néglige toute autre réaction. Quelle relation a-t-on, dans ces conditions, entre les quantités de matière de A- et H3O+ ?
2) On réalise la mesure du pH, à 25°C, en utilisant un volume V = 200 mL de chacune des deux solutions S1 et S2 . Des mesures précises de pH pour S1 et S2 permettent de calculer leurs concentrations effectives en ions oxonium :
[H3O+]1 = 1,3.10-3 mol.L-1 pour S1 et [H3O+]2 = 1,0.10-2 mol.L-1 pour S2
a) Calculer les quantités de matière en ions oxonium, n(H3O+ )1 et n(H3O+)2 dans chaque solution.
b) Calculer la quantité de matière d’acide HA1 et HA2 , initialement présente dans les 200 mL de chaque solution avant toute réaction avec l’eau.
c) Exprimer l’avancement maximal de la réaction et calculer sa valeur en fonction des données.
- Calculer l’avancement final xf1 et xf2 pour la réaction de chaque acide avec l’eau.
- Préciser la signification du taux d’avancement final et calculer t1 et t2 pour chaque réaction.
II ) Suivi spectrophotométrique :
L’une des deux réactions précédentes se caractérise par un taux d’avancement final maximal. Pour identifier précisement l’espèce acide qui participe à cette réaction, on introduit dans les 200 mL de cette solution 4 mL d’une solution de peroxyde d’hydrogène (H2O2 ), de concentration
C = 0,10 mol.L-1 . On observe alors l’apparition d’une coloration jaune très pâle qui se renforce progressivement ; cette coloration est caractéristique du diiode en solution aqueuse.
La transformation d’oxydoréduction qui se déroule alors peut
être décrite par l’équation suivante :
H2O2 (aq) + 2 H3O+(aq)
+ 2 I-(aq) = 4 H2O(l) + I2
(aq)
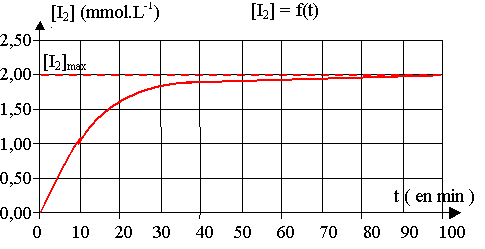
1) Par spectrophotométrie, on établit la courbe qui représente l’évolution de la concentration en diiode formé au cours du temps (courbe ci-après), ce qui permet de suivre le déroulement de la réaction.
a) Tracer les tangentes à la courbe aux points d’abscisse : t= 0 min ; t = 20 min ; t = 60 min.
b) Indiquer comment varie la vitesse de réaction au cours du temps. Justifier cette évolution.
c) A quelle date la vitesse de réaction est-elle maximale ?
d) Donner la définition du temps de demi-réaction t1/2 .
e) Faire sa détermination graphique sur la courbe donnée ci-avant et indiquer sa valeur.
2) La réaction (1) représente une transformation d’oxydoréduction :
a) Identifier les deux couples oxydant/réducteur mis en jeu dans cette équation.
b) Ecrire les demi-équations correspondantes.
c) Quelle est l’espèce chimique qui subit une oxydation ?
d) identifier l’espèce acide recherchée HA en donnant sa formule.
III ) Mesure conductimétrique :
Pour identifier à présent l’autre acide, on réalise une mesure de conductivité de sa solution ; on immerge la cellule du conductimètre dans les 200 mL de solution utilisée au I. 2) ; on obtient sexp. = 53,4 mS.m-1 .
La conductivité d’une solution est liée à la concentration
effective des espèces chargées en solution par la relation suivante :
s = (
lx+.[X+]
+ ly-.[Y-])
![]()
mS.m-1 mS.m2.mol-1 mol.m3
(pour une solution contenant les ions X+ et Y- )
1) Exprimer cette relation pour la solution acide étudiée, en considérant uniquement les ions formés après réaction de l’el(A-) = (s / [H3O+] ) - l(H3O+) = (53,4 / 1,3 ) – 35,0 = 6,1 mS.m2.mol-1 spèce acide avec l’eau.
2) En utilisant le résultat du I.1.c), exprimer la conductivité molaire ionique l(A-) de la base conjuguée de l’espèce acide, en fonction des autres grandeurs, s , l(H3O+), [H3O+].
Calculer sa valeur (utiliser les valeurs données en I.2) ).
3) En considérant les valeurs de conductivités molaires ioniques du tableau ci-dessous, identifier la nature de la base conjuguée présente en solution.
Donner la formule du deuxième acide recherché.
|
Formule de l’ion |
H3O+ |
NO3- |
HCOO- |
HO- |
CN- |
|
l (mS.m2.mol-1 ) |
35,0 |
7,14 |
5,46 |
19,9 |
7,80 |
©Sciences Mont Blanc
II ) Défibrillateur cardiaque :
©Sciences Mont Blanc
III ) L'âge de la Terre:
La détermination de l'âge de la Terre a commencé vers le XVIe siècle, on l'estimait alors autour de 5 000 ans. Au XIXe siècle, des scientifiques admettaient un âge d'environ 100 millions d'années.
La découverte de la radioactivité, par H. Becquerel en 1896, bouleversa toutes les données connues. La datation à l'uranium-plomb permit de déterminer assez précisément l'âge de la Terre.
Nous proposons de comprendre cette technique de datation.
I ) Etude de la famille Uranium – Plomb 206 :
Le noyau d'uranium 238, naturellement radioactif, se transforme en un noyau de plomb 206, stable, par une série de désintégrations successives. Nous allons étudier ce processus.
(On ne tiendra pas compte de l'émission g.)
1) Dans la première étape, un noyau d'uranium ![]() subit
une radioactivité a
. Le noyau-fils est du thorium (symbole Th).
subit
une radioactivité a
. Le noyau-fils est du thorium (symbole Th).
a) Qu'est-ce qu'un noyau radioactif ?
b) Ecrire l'équation de la réaction nucléaire en précisant les règles utilisées.
2) Dans la
deuxième étape, le noyau de thorium 234 se transforme en un noyau de protactinium
![]() . L'équation de la réaction nucléaire
est :
. L'équation de la réaction nucléaire
est : ![]() ®
®
![]() +
+ ![]()
Préciser, en justifiant, le type de radioactivité correspondant à cette transformation.
3) L'équation globale du processus de transformation d'un noyau d'uranium 238 en un noyau de plomb 206 est :
![]() ®
®
![]() + 8
+ 8 ![]() + 6
+ 6 ![]()
Déterminer, en justifiant, le nombre de désintégrations a et b- de ce processus.
II ) Géochronologie :
On a constaté, d'une part, que les minéraux d'une même couche géologique, donc du même âge, contiennent de l'uranium 238 et du plomb 206 en proportions remarquablement constantes et, d'autre part, que la quantité de plomb dans un minéral augmente proportionnellement à son âge relatif.
Si on mesure la quantité de plomb 206 dans un échantillon de roche ancienne, en considérant qu'il n'y en avait pas initialement, on peut déterminer l'âge du minéral à partir de la courbe de décroissance radioactive du nombre de noyaux d'uranium 238.
Etudions un échantillon de roche ancienne dont l'âge, noté tTerre , correspond à celui de la Terre.
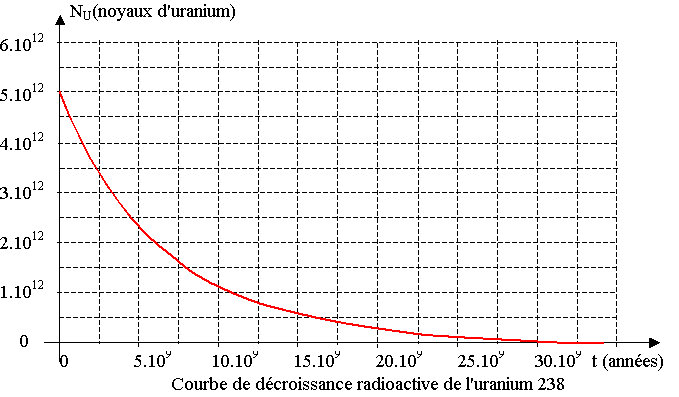
1) On considère la courbe de décroissance radioactive du nombre NU( t) de noyaux d'uranium 238 dans un échantillon de roche ancienne, voir l'annexe (à rendre avec la copie).
a) Indiquer la quantité initiale NU(0) de noyaux d'uranium.
b) Déterminer graphiquement la valeur de la constante de temps t de l'uranium 238 (représenter la construction sur la courbe de l'annexe). En déduire la valeur de sa constante de radioactivité l.
c) Donner l'expression de NU(t) , nombre de noyaux radioactifs présents dans l'échantillon à la date t, en fonction de NU(0).
Calculer le nombre de noyaux d'uranium 238 qui restent dans la roche à la date t1 = 1,5.109 ans. Vérifier graphiquement votre résultat.
d) Définir et déterminer graphiquement le temps de demi-vie t1/2 de l'uranium 238 (représenter la construction sur la courbe de l'annexe).
2) La quantité de plomb mesurée dans la roche à la date tTerre ,notée NPb(tTerre) , est égale à
2,5.1012 atomes.
a) Etablir la relation entre NU(tTerre) , NU(0) et NPb(tTerre) . Calculer la quantité NU(tTerre) de noyaux d'uranium.
b) Déterminer l'âge tTerre de la Terre.
Annexe (à rendre avec la copie)
©Sciences Mont Blanc
III ) (spe) Emission et réception
d'une onde modulée en amplitude :
©Sciences Mont Blanc
