Correction Bac Nouvelle Calédonie Mars 2004
Calculatrice autorisée
I ) Constante d'acidité de l'acide benzoïque (4 points)
III ) (4 points)
I ) (spe) (4 points)
I ) Constante d'acidité de l'acide benzoïque
:
I ) Détermination préalable de la concentration molaire apportée de la solution S0 d'acide benzoïque par titrage :
1) équation : C6H5-COOH(aq) + HO-(aq) = C6H5-COO-(aq) + H2O(l)
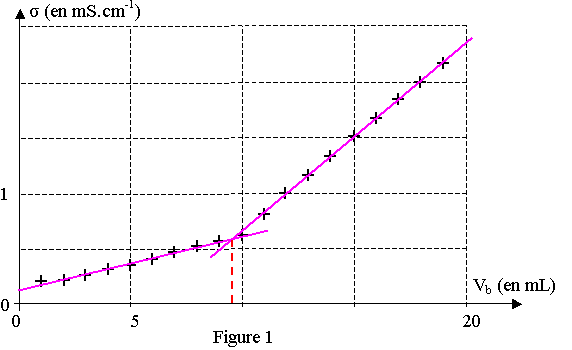
2) A l'équivalence, les réactifs ont été mélangés dans les proportions stoechiométriques et complètement consommés. On a donc : na = nb d'après l'équation. c0.V = cb.Véq
D'après le graphique, Véq = 9,5 mL
c0 = cb.Véq / V = 1,0.10-1 x 9,5.10-3 / 100,0.10-3 = 9,5.10-3 mol.L-1
II ) Constante d'acidité de l'acide benzoïque :
1) équation : C6H5-COOH(aq) + H2O(l) = C6H5-COO-(aq) + H3O+(aq)
2)
|
équation chimique |
C6H5CO2H(aq) + H2O(l) = C6H5-COO-(aq)+ H3O+(aq) |
||||
|
état du système |
avancement |
quantité de matière en mol |
|||
|
état initial |
0 |
n0 = c .V |
excès |
0 |
0 |
|
état intermédiaire |
x |
n = c .V – x |
excès |
x |
x |
|
état final ou équilibre |
xf = xéq |
nf = c .V – xf |
excès |
xf |
xf |
3) Qr = [H3O+].[C6H5-COO-]/[C6H5-COOH]
= (x/V).(x/V) / [(c.V – x)/V] = x2 / (V.(c.V – x))
Ka = Qr,éq = xéq2 / (V.(c.V – xéq))
4) t = xf / xmax = xéq / xmax
5) Si la réaction est totale, n(C6H5-COOH)f = 0 = c.V – xmax Þ xmax = c.V
xf = xéq = t . xmax = t . c . V
6) Ka = (t.c.V)2 / (V.(c.V - t.c.V)) = t2.c / ( 1 - t ) (1)
7) s = l(H3O+).[H3O+]éq + l( C6H5CO2-).[C6H5-CO2-]éq
D'après l'équation, [H3O+]éq = [C6H5-CO2-]éq. s = a.[H3O+]éq = a . xf / V = a . c . t
8) t = s / (a.c). relation (1) : Ka.(1 - s / (a.c)) = (s /(a.c))2.c Þ Ka.a2 – Ka.a.s / c = s2 / c
Soit k le coefficient directeur et j l'ordonnée à l'origine de la droite représentée.
D'après la relation 1, k = Ka . a et j = Ka . a2
k = Ka . a = -2,63.10-3 et j = Ka.a2 = 8,15.10-2
k2 / j = Ka = (-2,63.10-3)2 / 8,15.10-2 = 8,5.10-5
©Sciences Mont Blanc
©Sciences Mont Blanc
III ) :
©Sciences Mont Blanc
©Sciences Mont Blanc