Correction Bac Nouvelle Calédonie Novembre 2004
Calculatrice autorisée
II ) Etat final d'un système chimique : étude par spectrophotométrie (6,5 points)
III ) (4 points)
I ) (spe) (4 points)
I ) :
©Sciences Mont Blanc
II ) Etat final d'un système chimique : étude
par spectrophotométrie :
I ) Suivi spectrophotométrique de la transformation chimique.
1) On peut suivre la cinétique d'une réaction par pH-métrie si la réaction implique des ions H3O+ ou HO- , ou par conductimétrie si la réaction le permet, ou par mesure de pression d'un gaz
2) a) A = k . c ; k = A / c = 1,70 / 5,0.10-3 = 3,4.102 L.mol-1
b) A(t) = k . [I2] = k . n(I2)(t) / (V1+V2) ; n(I2)(t) = A(t).(V1+V2) / k
c) n(I2)(90) = 0,79 x (10,0 + 10,0).10-3 / 3,4.102 = 4,6.10-5 mol
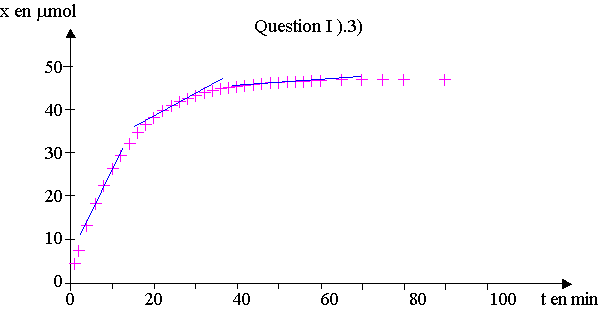
3) a) dx/dt correspond au coefficient directeur de la tangente à la courbe.
En traçant la tangente à différents points de la courbe , on constate que le coefficient diminue au cours du temps, la vitesse volumique diminue au cours du temps.
b) Au cours du temps, les concentrations des réactifs diminuent,
or c'est un facteur cinétique, cela diminue la vitesse de réaction.
c) Pour accélérer la réaction, on peut chauffer le mélange
réactionnel, ou ajouter un catalyseur de la réaction. Cela ne modifie pas
le mélange final.
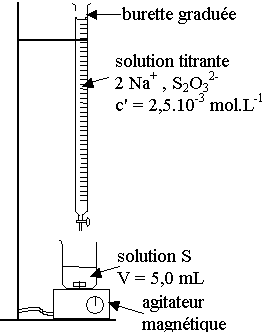 II ) titrage du diiode formé après 90 minutes
de réaction.
II ) titrage du diiode formé après 90 minutes
de réaction.
1) schéma du dispositif de titrage :
2) A l'équivalence, les réactifs ont été mélangés dans les proportions stœchiométriques de l'équation :
n(S2O32-)versé = 2 n(I2)0
3) Exploitation du titrage.
a) n(I2)0 = n(S2O32-)versé / 2 = c' . V'E / 2 (quantité dans un volume de 5 mL)
On cherche la quantité de I2 dans les 20 mL de solution, il faut donc multiplier par 4.
n(I2)90 = 2 c' . V'E
b) n(I2)90
= 2 x 2,5.10-3 x 9,2.10-3 = 4,6.10-5 mol
c) Cette valeur est la même que celle trouvée au I )2) .
III ) Etude théorique et bilan comparatif.
1) 2 I-(aq) = I2 (aq) + 2 e- et S2O82-(aq) + 2 e- = + 2 SO42-(aq) .
On les ajoute pour obtenir : 2 I-(aq)
+ S2O82-(aq) = I2 (aq) + 2 SO42-(aq)
2) a) n(I-)0 = c1 . V1 = 5,0.10-1 x 10,0.10-3 = 5,0.10-3 mol
n(S2O32-(aq))0 = c2 . V2 = 5,0.10-3 x 10,0.10-3 = 5,0.10-5 mol
|
Relation stœchiométrique |
2 I-(aq) + S2O82–(aq) = I2 (aq) + 2SO42–(aq) |
||||
|
Etat du système |
Avancement |
Quantité de matière en mol |
|||
|
Etat initial |
0 |
5,0.10-3 |
5,0.10-5 |
0,0 |
0,0 |
|
Au cours de la transformation |
x |
5,0.10-3 – 2x |
5,0.10-5 - x |
x |
2 x |
|
Etat final attendu |
xmax |
5,0.10-3 - 2xmax |
5,0.10-3 - xmax |
xmax |
2 xmax |
b) Si I- est le réactif limitant, n(I-)f = 0 = 5,0.10-3 - 2xmax ; xmax = 5,0.10-3 / 2 = 2,5.10-3 mol
Si S2O32- est le réactif limitant, n(S2O32-)f = 0 = 5,0.10-5 - xmax ; xmax = 5,0.10-5 mol
Le réactif limitant est donc S2O32- et xmax = 5,0.10-5 mol
D'après le tableau, n(I2)f = xmax = 5,0.10-5 mol
3) Par spectrophotométrie, on trouve n(I2) = 4,6.10-5
mol.
Par dosage, on trouve la même valeur pour n(I2).
D'après la question précédente, n(I2)th = 5,0.10-5 mol
½exp(I2) – nth(I2) ½/ nth(I2) = ½4,6.10-5 – 5,0.10-5½/ 5,0.10-5 = 0,080 = 8,0 %
Ce faible écart peut s'expliquer par des erreurs expérimentales de mesures.
©Sciences Mont Blanc
III ) :
©Sciences Mont Blanc
©Sciences Mont Blanc
