Sujet Bac Polynésie Septembre 2004
Calculatrice autorisée
II ) Oxydo-réduction (2,5 points)
III ) Estérification (4 points)
III ) Titre alcalimétrique d'une eau minérale (4 points)
I ) :
©Sciences Mont Blanc
On introduit dans un bécher 20 mL d’une solution de sulfate de cuivre (II) à 0,20 mol.L-1 et 20 mL d’une solution de sulfate de zinc (II) de même concentration.
On y plonge alors une lame de zinc et une lame de cuivre.
On observe : - la décoloration de la solution initialement bleue.
- un dépôt métallique sur la lame de zinc.
1) Écrire une équation de réaction associée à cette transformation.
2) Donner l’expression littérale du quotient de réaction Qr,i à l’état initial, puis faire l’application numérique.
3) Sachant que la constante d’équilibre K associée à la réaction :
Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq)
est égale à 1037, montrer que le sens d’évolution prévu en appliquant le critère d’évolution correspond aux observations expérimentales.
Partie 2 : Application aux piles
On construit maintenant une pile cuivre-zinc en reliant, par un pont salin, un bécher contenant 20 mL de la solution de sulfate de cuivre (II) précédente dans laquelle plonge une lame de cuivre à un bécher contenant 20 mL de la solution de sulfate de zinc (II) précédente dans laquelle plonge une lame de zinc.
On réalise un circuit série comprenant cette pile, un conducteur ohmique de résistance 10 W et un milliampèremètre.
1) Quel est le rôle du pont salin ?
2) En appliquant le critère d’évolution, déterminer la polarité des électrodes.
3) Donner les équations des demi-réactions aux électrodes ainsi que l’équation de la réaction associée à la transformation qui a lieu dans la pile.
4) Symboliser cette pile et préciser le sens du courant dans le circuit extérieur.
5) La pile en fonctionnement constitue-t-elle un système
dans l’état d’équilibre ou hors équilibre ? Justifier la réponse.
©Sciences Mont Blanc
III ) Estérification :
On utilise en parfumerie des esters odorants en particulier le benzoate de méthyle de formule C6H5-COO-CH3. On obtient celui-ci par une réaction d’estérification entre l’acide benzoïque et un alcool A en présence d’acide sulfurique.
Données :
|
Composés |
Masse molaire (g.mol-1) |
|
Benzoate de méthyle |
136 |
|
Acide benzoïque |
122 |
|
Alcool A |
32 |
Constante d’équilibre K associée à cette estérification K = 4
Les deux parties doivent être traitées dans l’ordre.
Partie 1 :
1) Donner le nom de l’alcool A. Donner la formule semi-développée de l’acide benzoïque.
2) Ecrire l’équation de la réaction d’estérification.
Partie 2 :
Dans le cas d’une estérification qui serait réalisée à partir d’un mélange équimolaire de réactifs (0,20 mol d’alcool A et 0,20 mol d’acide benzoïque) :
1) Dresser le tableau d’avancement correspondant à cette transformation chimique.
2) Ecrire l’expression littérale du quotient de réaction à l’équilibre Qr, éq, donner sa valeur et en déduire la valeur de l’avancement xéq à l’équilibre.
3) Exprimer le taux d’avancement final τ de cette réaction puis le calculer.
4) Déterminer la composition du mélange final.
5) On réalise un nouveau mélange initial (0,50 mol d’alcool A et 0,20 mol d’acide benzoïque). Calculer la valeur de l’avancement x’éq à l’équilibre. On aura à résoudre une équation du second degré.
6) En déduire le taux d’avancement final.
Que peut-on conclure de l’influence des proportions initiales des réactifs sur le déplacement de l'équilibre ?
©Sciences Mont Blanc
III ) Titre alcalimétrique d'une
eau minérale (spe):
Les eaux minérales contiennent de nombreuses espèces chimiques dissoutes. Ces eux minérales sont particulièrement riches en ions « bicarbonate ». Ce nom désigne en fait les ions hydrogénocarbonate HCO3–(aq).
Données :
- Zone de virage de quelques indicateurs colorés :
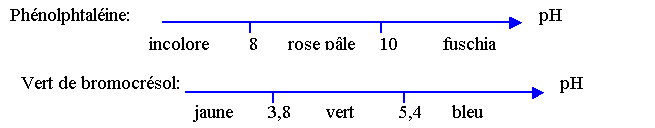
- Valeurs de quelques pKa de couples acido-basiques :
Pour le couple (H3O+ / H2O) : pKa1 = 0
Pour le couple (H2O / HO–) : pKa2 = 14
Pour le couple (CO2, H2O / HCO3–) : pKa3 = 6,3
Pour le couple (HCO3– / CO32–) : pKa4 = 10,3
- Masses molaires atomiques : M(H) = 1 g.mol-1 ;
M(O) = 16 g.mol-1 ;
M(C) = 12 g.mol-1 .
Pour effectuer le dosage alcalimétrique, on prélève V1 = 50,0 mL
d’eau minérale que l’on titre par une solution d’acide chlorhydrique de concentration
Ca = 2,0.10-2 mol.L-1.
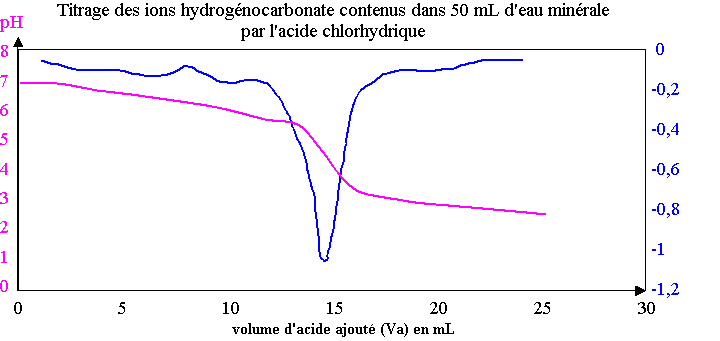
Un système d’acquisition permet de mesurer le pH au cours du dosage. On obtient ainsi la courbe donnant le pH en fonction de Va, volume d’acide versé, et celle de sa dérivée dpH/dVa = f(Va). Ces courbes sont données en annexe (à rendre avec la copie).
I ) Le titre alcalimétrique TA
La mesure du titre alcalimétrique TA permet de déterminer la concentration en ions carbonate CO32-(aq).
On donne la définition du TA : c'est le volume, exprimé
en millilitres, de solution d’acide chlorhydrique de concentration
Ca = 2,0.10-2 mol.L-1 en ions H3O+(aq)
nécessaires pour doser les ions carbonate CO32 - (aq)
dans 100 mL d’eau minérale en présence de phénolphtaléine.
1) En vous servant du diagramme donné en annexe, donner le pH de l’eau minérale.
2) Etablir le diagramme de prédominance des espèces carbonatées. En déduire
la forme prédominante de ces espèces dans cette eau minérale.
3) Quelle teinte prend la phénolphtaléine dans cette eau ?
4) Par ajout d’acide chlorhydrique, la phénolphtaléine changera-t-elle de
couleur ?
Peut-on déterminer par l’observation un volume équivalent ?
5) Justifier la valeur nulle du TA de cette eau minérale.
II ) Le titre alcalimétrique complet TAC
Le titre alcalimétrique complet TAC est lié à la concentration
totale en ions hydrogénocarbonate
HCO3-(aq) et carbonate CO32
- (aq).
On donne la définition du TAC : c’est le volume, exprimé en millilitres, de solution d’acide chlorhydrique de concentration Ca = 2,0.10-2 mol.L-1 nécessaires pour doser 100 mL d’eau minérale en présence de vert de bromocrésol.
1) Ecrire l’équation de la réaction utilisée pour le titrage.
2) Calculer na la quantité d'ions H3O+(aq)
introduite lorsque Va = 14,0 mL. Evaluer n'a la quantité d’ions
H3O+(aq) restant dans le volume total du
mélange réactionnel. Justifier l’utilisation de cette réaction pour réaliser
un dosage.
3) Déterminer les coordonnées du point d’équivalence.
4).Justifier le choix du vert de bromocrésol comme indicateur coloré.
5) Déterminer la concentration molaire C des ions hydrogénocarbonate dans
cette eau minérale.
6) Déterminer la concentration massique T des ions hydrogénocarbonate dans
cette eau minérale.
7) Déterminer le TAC de cette eau minérale.
Annexe
 |
©Sciences Mont Blanc
