Concours d’entrée en institut de formation de
Masso-Kinéthérapie Lariboisiere et St Maurice - Mai 2004
I ) L’aspirine, un antalgique célèbre ( 5 points )
II ) Etude d’une pile zinc – argent ( 5 points )
Date : Mardi 4 mai 2004 Durée de l'épreuve : 30 minutes Notée sur 10 points
1 - Les copies doivent être anonymes. Les nom, prénom et numéro d'inscription doivent être inscrits dans la case prévue à cet effet. La partie gommée doit être repliée et collée.
2 - Sous peine d'annulation de la copie, aucun signe distinctif ne doit apparaître sur la copie (pas de surligneur, pas de signature, pas de couleur...)
3 - Les brouillons ne seront pas ramassés.
4 - Les calculatrices sont interdites.
Epreuve de Chimie 30 min / 10 pts
L'usage de la calculatrice ou de tout matériel électronique(portable…) est strictement interdit.
Il sera tenu compte de la présentation, de la clarté de la rédaction et des raisonnements.
I - L'aspirine, un antalgique célèbre ( 5 points )
I ) Les groupes fonctionnels :
L'acide acétylsalicylique, constituant essentiel de l'aspirine, a pour formule semi-développée :
CH3–COO–C6H4–COOH
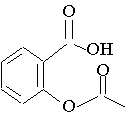
Sa formule topologique est représentée ci-dessous :
1) Recopier la formule topologique et entourer les deux groupes fonctionnels. Les nommer
2) Quelles sont les deux transformations chimiques que l'on peut envisager entre l'aspirine et une solution d'hydroxyde de sodium (soude) ?
Donner les conditions expérimentales de chacune des deux transformations.
II ) Couple acide / base :
L'aspirine est un acide de pKA = 3,5
1) Donner la formule semi-développée de sa base conjuguée.
2) Ecrire l'équation de la réaction associée à la transformation chimique de l'aspirine avec l'eau. Calculer le quotient de réaction Qr,éq Conclure.
3) Le pH est voisin de 1 dans l'estomac et de 8 dans l'intestin.
Sous quelle forme prédominante se trouve ce médicament dans ces deux organes, le justifier par la méthode de votre choix.
III ) Préparation de l'aspirine :
1) L'aspirine peut être préparée à partir de l'acide salicylique de formule HO–C6H4–CO2H et d'un acide carboxylique. Comment s'appelle cette réaction? Préciser le nom de l'acide utilisé.
2) On peut également préparer l'aspirine en utilisant un dérivé d'acide.
Préciser la formule de ce dérivé. Quel est l'intérêt de cette méthode ?
IV ) Titrage de l'aspirine :
L'étiquette d'un médicament contenant de l'aspirine indique une teneur de 350 mg en aspirine par comprimé. On se propose de vérifier cette valeur. Le mode opératoire est le suivant :
Ø Broyer le comprimé dans un mortier.
Ø Introduire
toute la poudre obtenue dans une fiole jaugée de 100,0 mL contenant environ
30 mL d'eau distillée.
Ø Boucher la fiole et agiter pendant quelques minutes. Lorsque la dissolution est totale, compléter avec de l'eau distillée jusqu'au trait de jauge.
Ø Boucher et homogénéiser la solution (S) obtenue.
Ø Prélever 20,0 mL de la solution (S) et la titrer avec une solution d'hydroxyde de sodium (ou soude) de concentration CB = 5,0.10-2 mo1.L-l
1) Représenter le montage à réaliser pour effectuer ce titrage par suivi pH-métrique
2) En notant HA l'acide acétylsalicylique, écrire l'équation de la réaction associée à la transformation chimique support de ce titrage.
3) Le pH à l'équivalence est supérieure à 7. Pourquoi ?
4) L'équivalence est obtenue pour un volume de soude versée VEq = 7,7 mL
En déduire la concentration de la solution (S).
5) En déduire la masse d'aspirine présente dans un comprimé.
Comparer ce résultat à l'indication de l'étiquette.
Donnée : M(aspirine) = 180 g.mol-1
II – Etude d'une pile zinc – argent ( 5 points )
Un élève veut réaliser une pile zinc-argent et dispose pour cela d'une lame d'argent, d'une lame de zinc, d'un bécher contenant un volume V1 = 100,0 mL de solution aqueuse de nitrate d'argent de concentration initiale en ions argent C1 = 0,20 mol.L-1 , d'un bécher contenant un volume
V2 = 100,0 mL de solution aqueuse de sulfate de zinc de concentration initiale en ions zinc
C2 = 0,10 mol.L-1 , d'un pont ionique au nitrate de potassium saturé. Le volume de chaque lame métallique est 10,0 cm3. Pour vérifier son fonctionnement, il dispose d'un voltmètre, d'un ampèremètre, d'un conducteur ohmique de résistance R et d'un interrupteur.
Données : Couples : Ag+(aq) / Ag(s) ; Zn 2+(aq) / Zn(s)
Constante d'équilibre de la réaction entre le zinc métal et les ions argent K = 1,0.1052
Masses molaires atomiques M(Ag) = 107,9 g.mol-1 ; M(Zn) = 65,4 g.mol-1
Masses volumiques : mZn = 7,1 g.cm-3 ; mAg = 10,3 g.cm-3
Constante de Faraday : 1 F = 96 500 C.mol-1
I ) Sens d'évolution spontanée du système.
1) Ecrire une équation de réaction possible décrivant le fonctionnement de la pile.
2) a) Calculer le quotient de réaction Qr, i à l'état initial
b) En déduire le sens d'évolution spontané du système chimique.
c) Ecrire l'équation de la réaction associée à la transformation chimique qui a effectivement lieu lors du fonctionnement de la pile.
d) En déduire les équations des réactions aux électrodes.
e) Donner la notation symbolique de cette pile.
II ) Pile en fonctionnement.
L'élève réalise la pile et branche un voltmètre aux bornes de celle-ci.
1) Faire le schéma annoté du circuit, en indiquant
Ø les polarités de la pile ;
Ø le sens du courant électrique ;
Ø le sens de déplacement de tous les porteurs de charge, en le justifiant.
L'élève réalise, à présent, un circuit en plaçant en série la pile, l'ampèremètre, le conducteur ohmique et l'interrupteur. Il ferme celui-ci et un courant électrique de 965 mA circule pendant
5 minutes.
2) Déterminer les concentrations finales en ions métalliques dans chaque demi-pile.
3) Déterminer les masses finales de chaque électrode.
©Sciences Mont Blanc