Chap 08 - Transformations associées à des réactions acido-basiques
![]()
en solution aqueuse (B.3)
I) Autoprotolyse de l'eau :
1) pH de l'eau pure.
pH de l'eau pure à 25°C : …. (valeur prise comme référence pour définir un milieu neutre )
Dans l'eau pure à 25°C , [H3O+] = …… ⇒ [H3O+] = ……….. mol.L-1
L'eau pure ne contient donc pas que des molécules d'…., mais aussi un peu d'…… ………….
Cela s'explique par une réaction entre 2 molécules d'…. :
2) Autoprotolyse de l'eau :
L'autoprotolyse de l'eau est la réaction entre deux molécules d'eau suivant le bilan :
H2O + H2O = ………….
Cette réaction est ………. avancée ([H3O+] est très ……). On remarquera que : [H3O+] =…….
Dans l'eau pure, il y a donc autant d'ions ………… que d'ions
oxonium à …. mol.L-1.
1L d'eau pure pèse 1000 g ; il y a donc presque ….. mol de molécules d'eau
par Litre.
3) Produit ionique de l'eau :
Définition : Le produit ionique de l'eau est la ………. d'équilibre associée à l'équation d'……………… de l'eau.
Cette constante est notée Ke. Ke = .........................
Ke s'exprime ….. unité et les concentrations sont exprimées en ……..
La constante d'équilibre est …………..de l'état initial (de la …………. initiale) et ne dépend que de la …………….
Pour toute solution aqueuse à 25°C, Ke = …………. (Ke …… lorsque la température augmente).
On note pKe = ……….. ⇒ pKe = …. à 25°C
On prend le logarithme de la relation Ke = ………. . ⇒ log Ke = ………………….
⇒ pKe = …………. ⇒ pH = ………… = 14 ……….. ⇒ [ HO- ] = ………
Echelle de pH :
Le pH des solutions aqueuses usuelles s'étend de … à …..
La nature acide, basique ou neutre d'une solution dépend de son …..
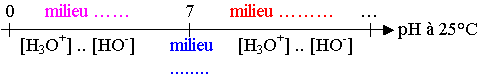
|
milieu |
eau de mer |
sang |
salive |
lait |
eau Perrier |
urine |
bière |
jus de tomate |
jus d'orange |
vin |
jus de citron |
suc gastrique |
|
pH |
8,0 |
7,35 |
7,0 |
6,8 |
6,0 |
6,0 |
4,5 |
4,2 |
3,5 |
3,5 |
2,2 |
2,0 |
II) Constante d'acidité KA et pKA :
1) Définition :
La constante d'acidité KA est la ………… d'équilibre associée à l'équation de la réaction d'un ……… avec ……..
équation : ………….. = …………… constante d'acidité : KA = ……………………
pKA est défini par la relation : pKA = ………. ou KA = ……..
2) Exemples : (valeurs à 25°C)
* Couple acide éthanoïque / ion éthanoate :
équation de la réaction avec l'eau : …………………. = ………………..
KA =…………………………….. KA = 1,58.10-5 et pKA = 4,80
* Couple ion ammonium / ammoniac :
équation de la réaction avec l'eau : …………………………….
KA = …………………………….. KA = 6,30.10-10 et pKA = 9,20
* Couples de l'eau. :
L'eau fait partie de deux couples acido-basiques : H2O / HO- et H3O+ / H2O
- 1er couple : H2O / HO- l'eau est ……….. du couple
équation de la réaction avec l'eau : …………… = ……………….. …………… de l'eau
KA1 = ……………… KA1 = …. = ………….. et pKA1 = ….. = …
- 2ème couple : H3O+ / H2O l'eau est ……….. du couple.
équation de la réaction avec l'eau : ……………= ……………….
KA2 = ........................... KA2 = … et pKA2 = …
L'eau se comporte comme …………… et comme …………, c'est un ………… (ou …………..).
III ) Comparaison du comportement des acides en solution aqueuse :
1) Forces relatives de deux acides :
Un acide A1H est plus fort qu'un acide A2H, si à concentrations égales, le taux d'avancement de sa réaction avec l'eau est plus ………. que celui de la réaction de l'acide A2H avec l'eau.
Soit τ1 … τ2.
2) Comparaison des pH des solutions de deux acides de forces différentes :
Pour des solutions de mêmes concentrations, l'acide le plus fort est celui dont le taux d'avancement final est le plus ……...
Donc c'est celui pour lequel [H3O+] est la plus ……...
[H3O+] et pH varient en sens …………. ( pH = …………).
L'acide le plus fort est celui pour lequel le pH est le plus …………..
3) Comparaison des constantes d'acidité KA :
On cherche à exprimer la constante d'acidité en fonction du taux d'avancement final de la réaction de l'acide avec l'eau.
tableau d'évolution de la réaction de l'acide avec l'eau :
|
Equation chimique |
AH + H2O = A- + H3O+ |
||||
|
Etat du système |
Avanc. |
Quantité de matière en mol |
|||
|
Etat initial |
0 |
||||
|
En cours |
x |
||||
|
Etat final |
xéq |
||||
Si la réaction était totale , n(AH)f = … ⇒ ……. - xmax = … ⇒ xmax = ……….
taux d'avancement final : τ = ………. = ………..
On note c la concentration initiale de l'acide ([AH]0 = c). n(AH)0 = ……
τ = ……… c.τ = …………..
On obtient les concentrations à l'équilibre en divisant les quantités de matière à l'équilibre (tableau) par le volume V de la solution :
[AH]éq = ………… = ………… , [A-]éq = …. et [H3O+]éq = ….
KA = ………………………… = ………………….. = ……………….
KA est donc une fonction ……………….. de τ.
Si A1H est plus fort que A2H, alors τ1 … τ2 et KA1 … KA2.
Un acide est d'autant plus fort que sa constante d'acidité KA est plus ……… ou que son pKA est plus ……….
Il est …… dissocié, son pH est plus ………, le taux d'avancement τ de la réaction est plus …..
IV ) Comparaison des bases en solution aqueuse :
* Une base B1 est plus forte qu'une base B2 ,si, à concentrations égales, le taux d'avancement de sa réaction avec l'eau est plus …… que celui de la réaction de la base B2 avec l'eau. Soit τ1 … τ2.
* La base la plus forte est celle qui capte le …. de protons, la solution a donc un pH le plus …...
* Pour une base forte en solution diluée (τ =….%) (exemple NaOH) : pH = ………… (à 25°C)
* Pour une base faible en solution diluée (τ ... 100%) (exemple NH3 ) : pH ………….. (à 25°C)
* Comparaison des constantes d'acidité :
couple A / B : équation : ………… = ……….. KA = ……………..
On cherche à exprimer le taux d'avancement à l'équilibre de la réaction de la base B avec l'eau.
Tableau d'évolution :
|
Equation chimique |
B + H2O = A + HO- |
||||
|
Etat du système |
Avanc. |
Quantité de matière en mol |
|||
|
Etat initial |
0 |
||||
|
En cours |
x |
||||
|
Etat final |
xéq |
||||
Si la réaction était totale, n(B)éq = … ⇒ …..- xmax = … ⇒ xmax = ……
taux d'avancement final : τ = ……… = ………….
On note c la concentration initiale de la base . τ = …………… ⇒ c.τ = ………..
On obtient les concentrations à l'équilibre en divisant les quantités de matière à l'équilibre (tableau) par le volume V de la solution : :
[B]éq = ………. = ……….. , [A]éq = ……. , [HO-]éq = …….
constante d'équilibre : K = ……………………… = ………………….. = ………………
La constante d'équilibre de la réaction de la base B avec l'eau est une fonction ……………. de τ.
Si la base B1 est plus forte que la base B2, si τ1 … τ2 alors K1 … K2 .
K = …………………… = …………………………….
K = ……… ⇒ KA = ………. Si K1 > K2 alors KA1 … KA2 ou pKA1 … pKA2.
Conclusion :
Une base est d'autant plus forte que la constante d'acidité KA du couple acide/base est plus …… ou que le pKA est plus …….
Elle est ……. dissociée, son pH est plus …..., le taux d'avancement τ de la réaction est plus …...
Ainsi, plus un acide est plus fort, plus sa base conjuguée est …….. et inversement.
V ) Diagramme de prédominance des espèces acido-basiques :
* Définition. : Une espèce A est prédominante par rapport à une espèce B si : …………..
* Pour déterminer les domaines de prédominance en fonction du pH, on cherche la relation donnant le pH d'une solution aqueuse contenant un acide A et sa base B :
KA = ……………………… ⇒ [H3O+]éq = …………………
⇒ - log[H3O+]éq = ………………………… = …………………
⇒ pH = ………………………..
log([B]/[A]) = ......................
* Il y a trois situations possibles :
A prédomine par rapport à B : [A] … [B] ⇒ [B] / [A] ..... ⇒ log([B]/[A]) .....
⇒ pH - pKA ..… ⇒ pH ... pKA
B prédomine par rapport à A : [A] … [B] ⇒ [B] / [A] ..... ⇒ log([B]/[A]) ......
⇒ pH - pKA ….. ⇒ pH … pKA
A et B à concentrations égales : [A] … [B] ⇒ [B] / [A] ..... ⇒ log([B]/[A]) ......
⇒ pH - pKA …… ⇒ pH … pKA
* Diagramme de prédominance :

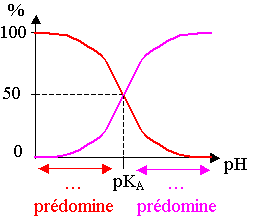
* Distribution des espèces acido-basiques :
Des logiciels de simulation tracent les courbes représentant les pourcentages des espèces acide A et basique B d'un couple dans une solution en fonction du pH de cette solution.
* Cas des indicateurs colorés :
Un indicateur coloré est un couple acide/base noté InH / In- , dont la forme acide InH et la forme basique In- ont des ………… différentes en solution.
En solution aqueuse, le couple est quasi instantanément en ……………:
...................... = ………………. avec pH = ……………………………..
La couleur observée lorsqu’on met quelques gouttes d’indicateur coloré dans une solution dépend du … de cette solution (on en met peu de façon à ………………………………….).
On admet que la solution dans laquelle se trouve l'indicateur a la couleur de la forme acide InH si :
[ InH ] eq …… [ In - ] eq ⇒ log [ InH ] eq / [ In - ] eq …. ⇒ log ([ In - ] eq / [ InH ] eq) ……
pH - pKindicateur …… ⇒ pH ……………..
On admet de façon semblable que la solution dans laquelle se trouve l'indicateur a la couleur de la forme basique si :
[In-] ….. [InH] ⇒ [In-]/ [InH] … ⇒ pH ………….
La solution prendra une couleur appelée …………….. (……………….. dues à la forme acide et à la forme basique) si :
[InH] et [In-] sont du ……………………, donc si : ……….< pH <………...

Diagramme de prédominance pour l'hélianthine :
La zone de virage est comprise entre ……… et ………… environ (soit entre 2,4 et 3,4)
VI ) Constante d'équilibre associée à une réaction acido-basique :
Une réaction acido-basique est un transfert de proton entre l'acide A1H d'un couple A1H/A1- et la base A2- d'un couple A2H/A2-.
demi-équations : …………. = …..………..
………….. = ....................
Equation : .................…. = ……………
Constante d'équilibre : K = ………………………………
KA1 = ……………………….. et KA2 = ……………………
On multiplie le numérateur et le dénominateur par [H3O+] :
K = ………………………………………… = ............... = ………………
Etude du sens d'évolution de la transformation :
La transformation est favorisée dans le sens où l'équation est écrite (de la gauche vers la droite) si K …...
Elle est favorisée dans le sens inverse (de la droite vers la gauche) si K …..
La transformation peut être considérée comme totale dans le sens de gauche à la droite
si pKA2 - pKA1 …………, si K ………….
La transformation peut être considérée comme totale dans le sens de droite à la gauche
si pKA2 - pKA1 …………., si K ………...
©Sciences Mont Blanc

