Sujet Bac Liban Juin 2003
Calculatrice autorisée
I ) Evolution temporelle de deux oscillateurs (9 points)
II ) Pile cuivre-argent (3 points)
III ) Etude de l'estérification (4 points)
Liban Juin 2003 - I ) Evolution temporelle de deux oscillateurs
A ) Oscillateur mécanique :
Une table à digitaliser est un dispositif permettant d'enregistrer les positions d'un système mécanique en fonction du temps.
Un solide S, de masse m = 100 g, relié à une soufflerie réglable est accroché à deux ressorts identiques à spires non jointives.
On enregistre la position de son centre d'inertie G au cours du temps à l'aide de l'ordinateur connecté à une table à digitaliser horizontale ( voir le schéma n°1)
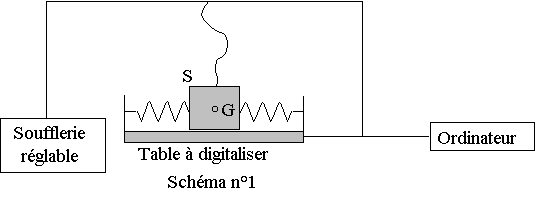
L'oscillateur décrit ci-dessus est équivalent à un solide de masse m accroché à un seul ressort à spires non jointives de constante de raideur k. La position du centre d'inertie G du solide est repérée par son abscisse x dans le repère (O, i ) ( voir le schéma n°2 de l'annexe à rendre avec la copie ).
A l'équilibre, le centre d'inertie G coïncide avec l'origine O du repère.
On réalise trois enregistrements dans les conditions suivantes :
a) soufflerie à puissance maximale ;
b) puissance de la soufflerie légèrement diminuée ;
c) puissance de la soufflerie fortement diminuée.
On obtient les enregistrements 1, 2 et 3 ci-dessous :



1) Indiquer pour chacun des trois enregistrements :
Ø la condition (a, b ou c) de fonctionnement de la soufflerie ;
Ø le régime d'évolution (périodique, pseudo-périodique ou apériodique).
Dans toute la suite on se place dans le cas où les frottements sont négligeables.
2) a) Sur le schéma n°2 (annexe page 8 à rendre avec la copie), représenter au centre de gravité G les forces s'exerçant à l'instant t sur le solide S, et les nommer.
b) En appliquant la deuxième loi de Newton, montrer que l'équation
différentielle du centre d'inertie G du solide S est : m + k.x = 0
+ k.x = 0
c) La solution analytique de l'équation différentielle est de la forme : x = XM.cos( 2p.t / T0 + F0 )
Comment nomme-t-on les constante XM et F0 ? Déterminer leurs valeurs sachant que S est lâché à t = 0 sans vitesse initiale au point d'abscisse x = 10,0 cm.
d) Déterminer la période propre T0 de l'oscillateur en utilisant l'un des enregistrements précédents.
e) A l'aide d'une analyse dimensionnelle, déterminer l'expression de la période propre T0 parmi celles proposées ci-dessous :
T0 = 2 p ![]() ( m / k ) ; T0
= 2 p
( m / k ) ; T0
= 2 p ![]() (
k / m ) ; T0
= 2 p.m / k
(
k / m ) ; T0
= 2 p.m / k
En déduire la valeur numérique de la constante de raideur k du ressort équivalent.
3) On étudie maintenant les différentes formes d'énergie du solide dans le cas du régime périodique.
a) Exprimer pour le système {ressort-solide S} à une date t, en fonction de k, m, x et v :
Ø l'énergie potentielle élastique Ep ,
Ø l'énergie cinétique Ec .
Donner l'expression de l'énergie mécanique E en fonction de Ep et Ec.
b) Que peut-on dire de l'énergie mécanique au cours du mouvement ?
Exprimer et calculer l'énergie mécanique à t = 0. En déduire la vitesse de S au passage par sa position d'équilibre.
c) Les figures données sur le schéma n°3 , (annexe page 8 à rendre avec la copie), représentent les variations au cours du temps des différentes énergies E, Ep, Ec.
Compléter le schéma en identifiant chacune des courbes. Justifier.
d) Dans le cas d'un régime pseudo-périodique, pourquoi l'énergie mécanique E diminue-t-elle au cours du temps ?
B ) Application des oscillations électriques :
Dans cette partie, on étudie une application des oscillations électriques dans le domaine de la météorologie. Pour mesurer le taux d'humidité relative de l'air ( noté % d'HR ), on peut employer un capteur appelé "humidistance" dont le principe simplifié utilise un condensateur de capacité variant avec l'humidité.
Pour mesurer la valeur de la capacité d'un condensateur, on peut le placer dans le circuit ci-dessous dans lequel la bobine d'inductance L a une résistance négligeable.

L'interrupteur est d'abord placé en position 1 pour charger le condensateur, puis basculé en position 2 pour le télécharger. Un système informatisé d'acquisition de données permet de relever la tension aux bornes du condensateur au cours de la décharge.
1) Suivant la valeur de la résistance R non nulle, l'évolution du système (R,L,C) se fait suivant deux régimes différents.
Tracer l'allure de la tension aux bornes du condensateur en fonction du temps pour ces deux régimes que l'on nommera.
2) On suppose maintenant que la résistance R est nulle ; reproduire la partie du circuit correspondant à la décharge. Etablir l'équation différentielle régissant l'évolution temporelle de la charge q du condensateur.
3) Vérifier que l'expression : q = QM.cos(2p.t / T0 + F0
) est solution de l'équation différentielle, si la période propre T0
a pour expression T0 = 2 p ![]() (L.C)
(L.C)
4) Le condensateur du capteur d'humidité est introduit dans le circuit précédent.
Dans les conditions atmosphériques de l'expérience, la période mesurée vaut T = 31,4 ms.
Sachant que l'inductance de la bobine est L = 200 mH, calculer la capacité du condensateur.
5) On lit sur la notice de l'appareil :
Caractéristiques du capteur d'humidité :
gamme de mesures : 10 à 100 % d'HR
sensibilité : 0,4 pF par % d'HR
capacité à 25°C et à 43 % d'HR : 122 pF
température d'utilisation : 0 à 85°C.
a) L'expression de la capacité C du capteur est une fonction affine croissante du taux d'HR notée h (exprimée en % d'HR). On peut donc écrire C =a.h + b
En vous aidant des caractéristiques du capteur, déterminer les valeurs des constantes a et b positives.
b) Dans les conditions expérimentales de la question 4, déterminer le % d'HR de l'atmosphère.
Exercice I : Annexe à rendre avec la copie


©Sciences Mont Blanc
Liban Juin 2003 - II ) Pile cuivre-argent
A partir des couples oxydant/réducteur Cu2+(aq)/Cu(s) et Ag+(aq)/Ag's), on peut envisager deux transformations dont les réactions peuvent être schématisées par les équations suivantes :
Cu(s) + 2Ag+(aq) = 2Ag(s) + Cu2+(aq) (1) et Cu2+(aq)+ 2Ag(s) = 2Ag+(aq)+ Cu(s) (2)
Les constantes d'équilibres de ces réactions sont K1 = 2,1.1015 et K2 = 4,8.10-16.
A) Transformation chimique spontanée par transfert direct d'électrons :
Un élève réalise l'expérience dont le protocole est donné
ci-dessous :
* Verser dans un bécher un volume V1 = 50 mL de solution de sulfate
de cuivre (II) de concentration molaire C1 = 10 mol.L-1
et un volume V2 = 50 mL d'une solution aqueuse de nitrate d'argent
de concentration molaire C2 = 0,50 mol.L-1. La solution
de sulfate de cuivre est bleue, celle de nitrate d'argent incolore.
* Plonger un fil d'argent et ajouter 3 g de poudre de cuivre de couleur rouge.
* Agiter ; filtrer la solution obtenue
et observer sa couleur.
L'élève note dans les observations de son
compte rendu de TP :" On observe un léger dépôt gris et une intensification
de la coloration bleue".
1) Parmi les deux réactions possibles quelle est celle associée à la transformation chimique du système ?
2) Rappeler le critère d'évolution spontanée.
3) Calculer le quotient de réaction initial puis, en appliquant le critère d'évolution spontanée, montrer que le sens d'évolution prévu est compatible avec les observations de l'élève.
B ) Constitution et fonctionnement de la pile cuivre argent en circuit fermé :
On dispose : d'un fil de cuivre, d'un fil d'argent, d'une solution de sulfate de cuivre (II) de volume
V1 = 50 mL et de concentration molaire C1 = 1,0 mol.L-1 , d'une solution de nitrate d'argent de volume V2 = 50 mL et de concentration molaire C2 = 1,0 mol.L-1 , d'un papier imbibé de nitrate de potassium pouvant constituer un pont salin.
1) Faire un schéma de la pile réalisable avec le matériel donné ci-dessus.
2) On observe dans
le circuit extérieur le passage d'un courant électrique de l'électrode d'argent
vers l'électrode de cuivre.
a) Préciser sur votre schéma le sens de circulation des électrons dans le
circuit et la polarité des électrodes.
b) Ecrire les équations des réactions modélisant les transformations ayant
lieu à chaque électrode.
c) Ecrire l'équation de la réaction associée à la transformation ayant lieu
dans la pile.
d) La pile cuivre-argent en fonctionnement est-elle un système dans l'état
d'équilibre ou hors équilibre ? Justifier
en utilisant le critère d'évolution spontanée.
©Sciences Mont Blanc
Liban Juin 2003 - III ) Etude de l'estérification :
Deux étudiants décident de refaire les expériences réalisées en 1862 par les chimistes Marcelin Berthelot et Léon Péan de Saint-Gilles, concernant la réaction d'estérification à partir de l'acide éthanoïque et de l'éthanol.
Ils préparent dix ampoules identiques. Ils introduisent dans chaque ampoule 0,10 mol de chacun des réactifs. Les ampoules sont fermées hermétiquement et placées dans une enceinte à température constante de 100°C, à une date prise comme date initiale (t=0).
A une date t donnée, ils sortent une ampoule de l'enceinte, la refroidissent rapidement et effectuent un dosage de l'acide éthanoïque restant avec une solution titrée d'hydroxyde de sodium en présence de phénolphtaléine.
Le tableau donné en annexe page 9 (à rendre avec la copie) donne les résultats des dosages successifs.
1) Ecrire l'équation de la réaction associée à l'estérification qui se produit dans chaque ampoule. Nommer l'ester formé.
2) Pourquoi refroidit-on rapidement les ampoules avant chaque dosage ?
3) A l'aide du tableau d'avancement de la réaction ayant lieu dans chaque ampoule ;
a) Déterminer l'avancement maximal.
b) Calculer l'avancement final xf dans chaque ampoule. Reporter ces valeurs dans le tableau donné en annexe page 9 ( à rendre avec la copie).
4) Définir le taux d'avancement final t. Pour chaque ampoule, calculer ce taux d'avancement et reporter ces valeurs dans le tableau donné en annexe à rendre avec la copie.
5) Sur une feuille de papier millimétré, tracer la courbe t(t) représentant la variation du taux d'avancement de l'estérification en fonction du temps.
Echelles : en abscisse 1 cm représente 20 h
en ordonnée 1 cm représente 0,05 ( ou 5 % )
6) A partir de l'allure de la courbe t(t), énoncer deux propriétés de la transformation étudiée.
7) Tracer, sur le même graphe, l'allure de la courbe qui serait obtenue si l'expérience était réalisée à une température plus élevée. Justifier.
Annexe : ( à rendre avec la copie )
Résultats des dosages des dix ampoules : quantité de matière d'acide éthanoïque (n)
en fonction de la date de prélèvement (t).
|
Date t (en h) |
0 |
4 |
10 |
20 |
40 |
100 |
150 |
200 |
250 |
300 |
|
Quantité de matière n (mmol) |
100 |
75 |
64 |
52 |
44 |
36 |
35 |
34 |
33 |
33 |
|
Avancement final xf (mmol) |
|
|
|
|
|
|
|
|
|
|
|
taux d'avancement t |
|
|
|
|
|
|
|
|
|
|
©Sciences Mont Blanc