Sujet Bac Nouvelle Calédonie Nov 2003
Calculatrice non autorisée
I ) Injections alcanisantes (4 points)
II ) Circuits RL et RLC (6,5 points)
III ) Influence des condition initiales sur le comportement d'un système (4 points)
I ) Dosage de la caféine (spe) (4 points)
Nouvelle Calédonie Nov 2003 - I ) Injections alcanisantes (4 points)
Des solutions d'hydrogénocarbonate de sodium ou de lactate
de sodium sont utilisées en injection par les
médecins pour leurs propriétés alcalinisantes (traitement de l'excès d'acidité)
L'ion lactate est la base conjuguée de l'acide lactique
( ou acide 2-hydroxypropanoïque) de formule
1) Recopier la formule de l'acide lactique. Entourer et nommer les groupes caractéristiques (ou fonctionnels) présents dans la molécule d'acide lactique, L'acide lactique sera noté AH dans la suite du problème
2) Ecrire la formule semi-développée de l'ion lactate. L'ion lactate sera noté A- dans la suite .
3) Pour vérifier la concentration d'une solution commerciale, on procède à un titrage pH-métrique des ions lactate contenus dans cette solution.
On prélève un volume V1 = 20,0 mL de solution S de lactate de sodium et l'on y verse une solution d'acide chlorhydrique H3O+ (aq) + Cl-(aq) concentration molaire en soluté apporté C2 = 1,0 mol.L-1 .
On mesure le pH au fur et à mesure de l'addition d'acide. On obtient la courbe de la page 3.
3.1) Ecrire l'équation de la réaction du titrage, la transformation associée étant considérée totale.
3.2) Déterminer graphiquement le volume d'acide versé à l'équivalence V2E, en indiquant la méthode choisie.
3.3) En déduire la concentration molaire en soluté apporté C1 de la solution de lactate de sodium. On pourra s'aider d'un tableau d'avancement.
3.4) Pour vérifier que la réaction .support du dosage est bien totale, on se place dans le cas particulier avant l'équivalence lorsque l'on a versé 9,0 mL d'acide.
3.4.1) Calculer la quantité d'ions oxonium H3O+ introduite dans ces conditions.
3.4.2) Le pH de la solution est alors égal à 4,0. Calculer la quantité d'ions oxonium H3O+ alors présente dans la solution.
3.4.3) En déduire que la transformation pouvait être considérée comme totale.
4) Dans le foie les ions lactate se décomposent en quelques heures en libérant des ions hydrogénocarbonate HCO3- .
4.1) Ecrire l'équation de la réaction des ions hydrogénocarbonate HCO3- avec les ions oxonium H3O+ contenus dans une solution acide. (Se référer aux couples indiqués dans les données).
La transformation associée sera considérée comme totale.
4.2) Quelle est la conséquence d'une injection de lactate ou d'hydrogénocarbonate de sodium sur le pH des liquides physiologiques contenus dans le corps en cas d'excès d'acidité.
Données : Couples AH / A- ; H3O+/ H2O ; H2O / HO- ; HCO3- / CO32- ; (CO2 ,H2O) / HCO3-

©Sciences Mont Blanc
Nouvelle Calédonie Nov 2003 - II ) Circuits RL et RLC (6,5 points)
L'objectif de cette étude est de retrouver expérimentalement la capacité d'un condensateur et l'inductance d'une bobine pour les comparer à celles données par le fabricant.
Le matériel disponible pour l'ensemble de cet exercice est le suivant :
* bobine d'inductance dont les indications du fabricant sont L = 1,0 H et r = 10 W ;
* Un condensateur dont l'indication du fabricant est C = 10 mF ;
* Un générateur de tension constante E=10 V ;
* Un conducteur ohmique R= 1,0 kW ; des fils de connexion ;
* Un interrupteur simple et un commutateur bipolaire ; un système d'acquisition informatisé

1) Etude expérimentale d'un circuit RL :
Le schéma du montage réalisé est représenté sur la figure 1
( le système d'acquisition est connecté mais non représenté sur la figure)
Une fois le paramétrage du système d'acquisition effectué, on ferme l'interrupteur à l'instant de date t0 = 0 s et on enregistre l'évolution de la tension aux bornes du conducteur ohmique de résistance R en fonction du temps. On obtient l'enregistrement représenté sur la figure 2.
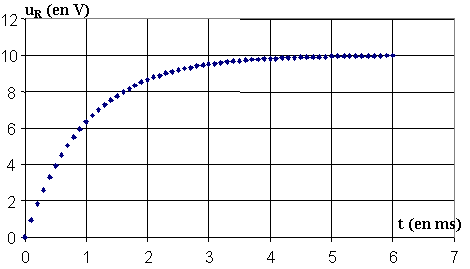
figure 2
1.1) L'adaptateur du système d'acquisition s'utilise comme un voltmètre. Il possède : deux bornes COM et V. Préciser les branchements à quels points du circuit il faut relier ces bornes pour obtenir la courbe de la figure 2.
1.2) On donne différentes courbes susceptibles de représenter l'intensité du courant en fonction du temps. Choisir celle qui correspond à l'évolution de l'intensité du courant en fonction du temps dans le circuit de la figure 1, après la fermeture de l'interrupteur.
Justifier à partir de la courbe expérimentale donnée sur la figure 2.


1.3) Quelle est l'influence de la bobine sur l'établissement du courant à la fermeture du circuit ?
2) Modélisation et équation différentielle
2.1) Si l'on considère que la résistance r de la bobine est négligeable devant R, montrer que l'équation différentielle du circuit, interrupteur fermé, peut s'écrire : E = uR + (L/R). duR/dt.
2.2) Le terme (L/R) correspond est la constante de temps t de ce circuit (dans lequel on a négligé r par rapport à R). Par une analyse dimensionnelle montrer que cette constante a la dimension d'un temps (ou d'une durée).
2.3) On note uR(t) la valeur prise par uR à l'instant de date t = t. Sachant que uR(t) = 0,63 uR max , avec uR max , valeur maximale atteinte par la tension uR, déterminer à partir du graphe de la figure 2 la valeur de la constante de temps t de ce circuit.
2.4) En déduire la valeur de L et la comparer avec l'indication du fabricant.
3) Résolution numérique de l'équation différentielle par la méthode d'Euler :
La méthode de résolution numérique d'Euler permet de trouver des couples de valeurs (t, uR) qui vérifient l'équation différentielle du 2.1. On rappelle que les couples de valeurs sont liés par la relation :
uR(tn+1)= uR(tn) + DuR(tn) avec DuR(tn) = (duR/dt)(tn).Dt
et tn+1 = tn + Dt où Dt le pas de la méthode numérique
3.1) A partir de l'expression du 2.1 , exprimer duR/dt en fonction de uR et des données.
3.2) La tension uR est initialement nulle. Pour compléter progressivement le tableau de la page A3 de l'annexe, en utilisant le pas de valeur Dt = 1,0.10-4 s, calculer littéralement puis numériquement, duR/dt à la date t = 0 s puis uR(tDt) à la date t = Dt, duR/dt à la date Dt puis uR(t2Dt) à la date 2Dt. Présenter tous les résultats numériques dans le tableau de la page A3 de l'annexe à rendre avec la copie.

A l'aide d'un tableur grapheur on continue les calculs pas à pas jusqu'à t =
5 ms Les valeurs calculées de uR(t) , sont portées sur le graphique
de la figure 3 et sont représentés par le symbole + Sur la même figure, on porte aussi les valeurs expérimentales
de uR(t), que l'on représente par le symbole ·.
Chaque · représente une valeur expérimentale.
Chaque + représente une valeur
calculée par la méthode numérique d'Euler avec Dt = 1,0.10-4 s.
3.3) Quelle serait qualitativement l'influence d'une augmentation du pas de calcul Dt sur l'écart entre le nuage de points ainsi obtenu par la méthode d'Euler et la courbe expérimentale ?
 4)
Etude du circuit oscillant :
4)
Etude du circuit oscillant :
On réalise ensuite le montage correspondant au schéma de la figure 4.
On bascule le commutateur en position 1 pour charger le condensateur puis on le bascule en position 2. Avec le même système d'acquisition et de traitement qu'au 1, en adaptant le paramétrage, on enregistre la tension uC(t) dont le graphe est représenté sur la figure 5.
L'enregistrement débute à l'instant de date t0 = 0 s qui correspond au basculement du commutateur en position 2.

figure 5
4.1)
Comment peut-on expliquer la diminution d'amplitude des oscillations au cours
du temps ?
4.2) Déterminer la valeur de la pseudo-période du signal.
4.3) Ici on peut considérer que la période propre et la pseudo-période ont
la même expression. En déduire la valeur de la capacité C du condensateur
et comparer avec l'indication du fabricant.
On donne p2 » 10
ANNEXE A3 - EXERCICE II
|
date |
Valeur de uR(t) en (V) |
Valeur de duR/dt |
|
t0 = 0 s |
uR(0) = 0,000 |
(duR/dt)(0) = |
|
t = Dt |
uR(Dt) = |
(duR/dt)(Dt) = |
|
t = 2 Dt |
uR(2Dt) = |
|
©Sciences Mont Blanc
Nouvelle Calédonie Nov 2003 - III ) Influence des condition initiales sur le comportement d'un système (4 points)
Partie 1 : Un système physique :

Pendant son entraînement, un golfeur cherche à envoyer directement la balle
dans le trou se trouvant sur le green. Pour cela, il doit faire passer la
balle au dessus d'un petit plan d'eau se trouvant entre lui et le green (
voir figure 1). On néglige tout mouvement de rotation de la balle sur elle-même.
Il fait varier séparément des caractéristiques du vecteur vitesse initiale
de la balle.
Dans cette étude la vitesse atteinte par la balle étant faible, on considère comme négligeables les frottements de l'air dans tout l'exercice. A l'aide de la deuxième loi de Newton, dans le référentiel terrestre supposé galiléen, on peut établir les équations horaires du mouvement de la balle ainsi que l'équation de sa trajectoire dans le repère (O, x, y).
On appelle portée du lancer la distance D atteinte par la balle lorsqu'elle retombe sur le sol ( sur le même plan horizontal que le point de départ) et flèche du lancer la hauteur maximale H atteinte par la balle pour une abscisse égale à D/2 (voir figure 1)
On montre que leurs expressions respectives sont : D = 2 v02.cos a.sin a / g et H = v02.sin2a / 2g
1) Exprimer les coordonnées v0x et v0y du vecteur vitesse v0 dans le repère (O , x , y ) .
2) Exprimer la portée D et la flèche H en fonction de l'une ou des coordonnées du vecteur vitesse initiale v0 .
3) Le golfeur réussit son coup pour un vecteur vitesse initiale v0 . Il rejoue maladroitement le coup avec une vitesse initiale égale à v1 ( voir figure 2 de l'annexe page A4). Exprimer les nouvelles valeurs D1 et H1 de la portée et de la flèche en fonction de D et H.
Dessiner l'allure de la nouvelle trajectoire sur la figure 2 de l'annexe page A4 A RENDRE AVEC LA COPIE;
4) Il rejoue le coup avec une vitesse initiale égale à v2 ( voir figure 3 de l'annexe page A4 A RENDRE AVEC LA COPIE.
Exprimer les nouvelles valeurs D2 et H2 de la portée et de la flèche en fonction de D et H.
Dessiner l'allure de la nouvelle trajectoire sur la figure 3 de l'annexe page A4 A RENDRE AVEC LA COPIE
5) Il envoie la balle en conservant le même angle de tir a mais en frappant plus fort. Prévoir qualitativement (sans calcul) les conséquences sur la portée et la flèche de ce nouveau tir.
Partie 2 : Un système chimique
On réalise une pile avec les couples Ag+ / Ag et Fe3+ / Fe2+
 La
constante d'équilibre associée à la réaction Ag+(aq)+Fe2+(aq)
= Ag(s)+ Fe3+(aq) a pour valeur K
= 3,2
La
constante d'équilibre associée à la réaction Ag+(aq)+Fe2+(aq)
= Ag(s)+ Fe3+(aq) a pour valeur K
= 3,2
On simplifiera les notations en écrivant Xn+(aq) sous la forme Xn+ .
1) Donner l'expression du quotient de réaction.
2) Dans la pile, les concentrations molaires initiales des ions dans les solutions aqueuses sont : [Ag+]i = [Fe2+]i =[Fe3+]i = 1,0.10-1 mol.L-1
Calculer le quotient de réaction à l'état initial.
3) En déduire le sens d'évolution spontané de la réaction quand la pile fonctionne.
4) Quelle est la polarité de chaque électrode ? Justifier à partir des demi-équations.
5) On réalise une deuxième pile en modifiant les conditions initiales du système. Les concentrations initiales sont désormais [Ag+]'i = [Fe2+]'i = 1,0.10-1mol.L-1 et [Fe3+]'i =1,0.10-2mol.L-1
La polarité de chaque électrode reste-t-elle la même ? Justifier.

ANNEXE – EXERCICE III

Page annexe : A4
©Sciences Mont Blanc
Nouvelle Calédonie Nov 2003 - I )(spe) Dosage de la caféine (4 points)
Selon la légende, le café fut remarqué pour la première fois quelques 850 ans avant notre ère: un berger du Yémen nota que ses brebis étaient dans un état d'excitation inhabituel lorsqu' elles consommaient les baies d'un arbre des montagnes... On considère que c'est la caféine contenue dans les grains de café de ces baies qui était l'espèce responsable de cette excitation.
Plus la teneur en caféine d'une tasse de café est importante, plus l'excitation du consommateur sera grande.
Le but de l'exercice est de déterminer la concentration en caféine dans deux tasses de café de provenances différentes (notées boisson 1 et boisson 2) pour déterminer celui qui est le plus excitant (question 111-2.).
On extrait la caféine des feuilles de thé et, avec la caféine purifiée, on prépare des solutions de caféine de différentes concentrations.
A l'aide d'un spectrophotomètre, on mesure ensuite l'absorbance A de ces solutions de caféine.
I ) Extraction de la caféine :
Le thé contient environ 5 % de caféine, mais il contient aussi d'autres substances comme des sucres, des pigments, des graisses, ...
Données :
|
Dans le |
Dans l'eau |
Dans l'eau |
|
|
dichlorométhane |
à 25°C |
à 65°C |
|
|
Solubilité de la caféine |
importante |
faible |
très importante |
Ø Le dichlorométhane a pour densité 1,30 et se trouve à l'état liquide dans les conditions de l'expérience.
Ø Le dichlorométhane n'est pas miscible à l'eau.
L'extraction de la caféine se fait en quatre étapes :
Étape 1 : dans un ballon surmonté d'un réfrigérant, on introduit des feuilles de thé et de l'eau distillée. Le chauffage et l'agitation durent 2 heures.
Étape 2 : la phase aqueuse précédente est refroidie et mélangée à du dichlorométhane. Seule la phase organique est recueillie.
Étape 3 : la phase organique est mélangée à du sulfate de magnésium anhydre puis filtrée.
Étape 4 : après évaporation du solvant, on obtient une poudre blanche qui contient principalement de la caféine.
1) Dans l'étape 1, quel est le rôle du réfrigérant ? Le schématiser surmontant le ballon sans oublier la circulation d'eau.
2) En utilisant les données, justifier le chauffage dans cette première étape.
3) Pour l'étape 2, dessiner le dispositif permettant de recueillir la phase organique et indiquer la position des phases aqueuse et organique. Dans quelle phase se trouve la quasi-totalité de la caféine extraite (justifier) ?
4) Dans l'étape 2, quelle technique est mise en œuvre ?
5) Quel est le rôle du sulfate de magnésium anhydre ?
6) Il est possible de purifier un solide tel que la caféine extraite. Nommer une technique de purification d'un solide.
II ) Préparation de solutions de caféine de différentes concentrations
Avec la caféine extraite que l'on a purifiée, on fabrique une solution de caféine dans le dichlorométhane de concentration 32 mg.L-1 .
On désire préparer des solutions de concentrations 4 mg.L-1 , 8 mg.L-1 , 12 mg.L-1 et 16 mg.L-1 .
Parmi le matériel suivant, indiquer celui utilisé pour préparer la solution de caféine de concentration 16 mg.L-1 . Justifier votre choix
Matériel à disposition :
Ø béchers de 100 mL et 200 mL ;
Ø fioles jaugées de 5,0 mL ; 10,0 mL et 50,0 mL ; .
Ø pipettes jaugées de 2,0 mL et 5,0 mL ;
Ø éprouvette graduée de 5 mL.
III ) Mesure d'absorbance :
On a tracé ci-après (figure 1) le spectre d'absorption de la caféine entre 220 nm et 320 nm pour une des solutions de caféine.
 1)
A quel domaine appartiennent ces longueurs d'onde ?
1)
A quel domaine appartiennent ces longueurs d'onde ?
On veut tracer la courbe d'étalonnage A = f (c) de la caféine à l'aide des différentes solutions précédemment préparées.
Pour cela, il faut régler le spectrophotomètre sur une longueur d'onde correspondant à un maximum d'absorption de la caféine.
On choisit de se placer à une longueur d'onde de 271 nm et l'on mesure les absorbances des 5 solutions de caféine. A l'aide de ces mesures, on obtient la courbe A= f(c) ci-après (figure 2).
2) Sans changer les réglages du spectrophotomètre, on mesure les absorbances des boissons 1 et 2. On trouve A1 = 0,17 pour la boisson 1 et A2 = 0,53 pour la boisson 2.
Quel est le café le plus excitant pour le consommateur ?
3) A l'aide de la droite d'étalonnage, trouver quelle est la concentration de la solution qui a servi à faire le spectre d'absorption de la figure 1.
4) Parmi les 3 droites d'étalonnage de la figure 3, l'une correspond à l'étalonnage effectué à 228 nm. Sachant que la droite (2) correspond à un étalonnage à 271 nm, en déduire celle qui correspond à l'étalonnage à 228 nm.


©Sciences Mont Blanc