Sujet Bac Amérique du Sud Novembre 2004
Calculatrice autorisée
I ) Mouvements plans (4 points)
II ) Du bing bang aux éléments chimiques (6 points)
III ) Préparation d'un savon
parfumé à la lavande (4 points)
I ) Comment accorder une guitare (spe) (4 points)
Amérique du Sud Novembre 2004 - I ) Mouvements plans
:
Cet exercice comporte 8 affirmations.
A chaque affirmation, vous répondrez par VRAI ou par FAUX en justifiant votre choix à l’aide de démonstrations de cours et de définitions, de calculs, de schémas ou d’analyses dimensionnelles. Toute réponse non justifiée ne rapportera aucun point.
1) On considère un projectile évoluant dans le champ de pesanteur terrestre supposé uniforme.
Le projectile de masse m est lancé à la date t = 0 s d’un point O, origine du repère (O, x, z).
Le vecteur vitesse initial v0 fait un angle a quelconque avec l’horizontale. Le mouvement s’effectue dans le plan vertical contenant les axes Ox et Oz , tel que le champ de pesanteur g est parallèle à Oz. On se place dans le référentiel terrestre supposé galiléen.
On néglige toute résistance de l’air.

1.1) AFFIRMATION : le vecteur accélération aG du centre d’inertie G du projectile ne dépend pas des conditions initiales.
1.2) AFFIRMATION : le projeté du centre d’inertie G du projectile sur l’axe vertical Oz est animé d’un mouvement rectiligne et uniforme.
1.3) AFFIRMATION : la trajectoire du centre d’inertie G du projectile est parabolique quelque soit la valeur de a.
1.4) AFFIRMATION : dans le cas où le projectile est
lancé d’une hauteur H au dessus du sol avec une vitesse v0
horizontale, l’abscisse de son point de chute est x = v0. ![]() (2 H / g)
(2 H / g)
On rappelle qu’à t = 0 s, le projectile est en O, origine du repère.
2) On considère un satellite artificiel soumis uniquement à la force gravitationnelle de la Terre.
Le satellite de masse m, situé à l’altitude h par rapport au sol terrestre est animé d’un mouvement circulaire et uniforme à la vitesse V. On se place dans le référentiel géocentrique supposé galiléen.
On donne : le rayon de la Terre : RT = 6380 km
la masse de la Terre : MT = 5,98.1024 kg
la constante de gravitation universelle : G = 6,67.10 -11 S.I.

2.1) AFFIRMATION : la constante de gravitation universelle G s’exprime en m.s-2.
2.2) AFFIRMATION : le vecteur accélération aG du centre d’inertie du satellite est centripète.
2.3) AFFIRMATION : la vitesse du satellite est donnée
par la relation v = ![]() (G.MT / (RT + h) )
(G.MT / (RT + h) )
2.4) AFFIRMATION : à l’altitude h = 12 800 km, la période de révolution du satellite vaut 2,64. 104 s
©Sciences Mont Blanc
Amérique du Sud Novembre 2004 - II ) Du bing
bang aux éléments chimiques :
Tous les extraits encadrés sont tirés de « L’Univers des étoiles » de L.BOTTINELLI et
J.L. BERTHIER.
|
1) Remontons l’écoulement du temps jusqu’à l’instant le plus originel de l’histoire universelle. Au début était la lumière ! Inconsistance du monde contenant une incroyable, une fantastique quantité d’énergie. Tout ce que l’univers compte actuellement de galaxies, d’étoiles, de planètes, d’êtres ou d’objets étaient là en germe sous forme d’énergie immatérielle. La théorie du Big Bang sans cesse réaffirmée explique que, durant le premier quart d’heure, de ce chaos énergétique très agité sont nées les particules de matière fondamentales : protons, neutrons, électrons… Après les particules de base, mais bien plus tard, des galaxies prennent forme, puis des étoiles apparaissent dans les galaxies. Par le truchement de la nucléosynthèse, la variété des éléments chimiques voit enfin le jour dans les étoiles… Ainsi, l’Univers s’est développé transformant son capital initial énergie en capital matière… |
1.1) A quelle équivalence fait allusion le texte, en particulier dans la dernière phrase ?
1.2) Donner une relation permettant de définir cette équivalence.
Préciser la signification de chaque terme employé dans cette relation ainsi
que son unité dans le système international.
|
2. La température de l’univers qui diminue au cours du temps, va régler durant le premier quart d’heure la création de tel ou tel type de particule… Mais créer une particule implique nécessairement de créer simultanément son antiparticule, toutes deux de masse identique… |
Calculer l’énergie de masse nécessaire à la création de la paire particule-antiparticule
positron-électron de masse 2 me.
L’exprimer en J, puis en MeV.
On donne : célérité de la lumière : c = 2,998. 108
m.s-1
masse du positon = masse de l’électron = me= 9,11.10 -31 kg
l’électron
volt : 1 eV = 1,602.10 -19 J
|
3. Au bout du premier quart d’heure, lorsque la température a chuté jusqu’à 300 millions de degrés environ, les protons et les neutrons, rescapés de l’annihilation matière-antimatière, s’associent en noyaux légers, essentiellement en noyaux d’hydrogène, de deutérium et d’hélium… |
Donner la composition du noyau de deutérium 21H
|
4. 30 millions d’années plus tard, c’est au cœur même des étoiles que la nature va poursuivre son œuvre. Cela commence par la [ … ] thermonucléaire de l’hydrogène en hélium. Cette transformation occupe l’essentiel de la vie des étoiles et ne nécessite pour ainsi dire, qu’une température de 10 millions de degrés. Son bilan s’écrit : 4 11H ® 42He + 2 01e |
4.1) Que représente 01e ?
4.2) Dans la deuxième ligne du texte ci-dessus, le nom de la réaction nucléaire
mise en jeu a été effacé. Quel est-il ?
4.3) Enoncer les lois de conservation qu’elle vérifie.
4.4) Calculer la perte de masse lors de cette réaction nucléaire.
On donne : masse d’un noyau d’hydrogène 1 11H :
mH = 1,6726. 10 -27 kg
masse d’un noyau d’hélium 4 42He : mHe = 6,6447.10 -27 kg
masse de la particule 01e :
me = 9,11.10 -31 kg
|
5. Sur la fin de leur existence (stade de dilatation de l’enveloppe extérieure ou géante rouge), une contraction brutale du cœur des étoiles, accompagnée d’une forte élévation de température (jusqu’à 100 millions de degrés) permet la formation d’éléments plus lourds. Le processus qui conduit au carbone par fusion de l’hélium est appelé triple alpha et son bilan s’écrit : 3 42He ® 126C + g |
Qu’est-ce qu’une particule alpha ? Justifier le nom du processus.
|
6. …Seules les étoiles de masse supérieure ou égale à trois masses solaires, atteignant des températures plus élevées, ont le privilège de créer des éléments encore plus lourds. A 800 millions de degrés, le carbone fusionne en magnésium ( Z = 12 ), à 1 milliard de degrés, l’oxygène (Z=8) fusionne en silicium( Z = 14 ) et à 4 milliards de degrés, le silicium fusionne en fer ( Z = 26 ) … |
On donne : énergie de liaison d’un noyau de carbone
12 126C : El = 92,2 MeV
6.1) Définir l’énergie de liaison.
6.2) Calculer l’énergie moyenne de liaison par nucléon d’un noyau de carbone
12.
Le tableau suivant donne les énergies moyennes de liaison par nucléon de quelques
noyaux :
|
42He |
5626Fe |
23892U |
|
|
El / A en MeV/nucléon |
7,1 |
8,8 |
7,6 |
6.3) Parmi ces trois noyaux, lequel est le plus stable ? Justifier.
6.4) En utilisant la courbe d’Aston donnée en annexe, répondre aux questions
suivantes :
6.4.1) Comment évolue la stabilité d’un noyau quand son nombre de nucléons augmente ? Distinguer trois domaines.
6.4.2) Quels sont les deux types de réactions nucléaires qui permettent d’accéder au maximum de stabilité ? Préciser dans quel domaine.
6.4.3) Justifier pourquoi la synthèse des éléments chimiques au cœur des étoiles s’arrête à l’élément fer.
|
7. …La synthèse des noyaux plus lourds que le fer se réalise par un processus de capture de neutrons lors de l’explosion finale d’une grosse étoile en supernova. Deux scénarios peuvent se produire : 1ère possibilité : le noyau tout neuf, riche d’un neutron supplémentaire, est stable et peut éventuellement capturer d’autres neutrons. 2ème possibilité : le noyau nouvellement créé est instable et subit une désintégration b- . |
7.1) Le premier scénario permet-il de créer des éléments chimiques différents ?
Justifier.
7.2) Soit AZX , le noyau nouvellement créé dans le second
scénario et Y, son noyau fils. Ecrire l’équation générale de sa désintégration
en fonction de A et Z.
7.3) Peut-on, a priori, obtenir tous les éléments chimiques de numéro atomique
supérieure à Z ? Justifier.

©Sciences Mont Blanc
Amérique du Sud Novembre 2004 - III ) Préparation
d'un savon parfumé à la lavande :
Un professeur de chimie propose à ses élèves de terminale S de préparer un savon parfumé à la lavande sur deux séances de travaux pratiques.
1) Séance n° l : préparation du parfum à odeur de lavande.
Le parfum à odeur de lavande, ou acétate de linalyle, utilisé pour parfumer le savon est une espèce chimique présente dans l'essence naturelle de lavande. Mais il peut aussi être préparé au laboratoire, entre autres par action de l'acide acétique sur le linalol.
A température ordinaire, le linalol se présente sous la forme d'un liquide incolore et odorant, de formule semi-développée :

Données
|
Nom de l’espèce chimique |
Acétate de linalyle |
Linalol |
Acide acétique |
Anhydride acétique |
|
Densité |
0,89 |
0,87 |
1,05 |
1,08 |
|
Température
d'ébullition |
220°C |
199°C |
118°C |
139,5°C |
|
Masse molaire (g.mol-1) |
196 |
154 |
60 |
102 |
 1.1) Recopier la formule semi-développée du linalol et
entourer le groupe caractéristique de la fonction alcool.
1.1) Recopier la formule semi-développée du linalol et
entourer le groupe caractéristique de la fonction alcool.
1.2) A quelle famille chimique l'acétate de linalyle appartient-il ?
1.3) En utilisant les formules semi-développées, écrire l'équation de la réaction correspondant à la préparation de l'acétate de linalyle. Quelles sont les caractéristiques de cette réaction ?
1.4) On utilise un mélange équimolaire de linalol et d'acide acétique en présence d'acide para-toluène sulfonique qui joue le rôle de catalyseur.
1.4.1) Qu'est-ce qu'un catalyseur ?
1.4.2) On donne la valeur de la constante d'équilibre de la réaction :
K = 3.10 -3
Ecrire l’expression du quotient de réaction à l'état initial Qr,i de la transformation. Justifier le sens d'évolution du système.
1.5) On utilise le montage représenté à la figure 1 ci-contre.
1.5.1) Comment s'appelle le montage de la figure 1 ? Quel est son rôle ?
1.5.2) Indiquer le sens de circulation de l'eau en utilisant deux des lettres a, b et c.
1.5.3) Quelles espèces sont présentes dans le ballon lorsque le système chimique n'évolue plus ?
 1.6) Une fois la transformation terminée, après
refroidissement, on garde le ballon et son contenu et on change la partie
supérieure du montage qui devient alors celui de la figure 2 ci-après.
1.6) Une fois la transformation terminée, après
refroidissement, on garde le ballon et son contenu et on change la partie
supérieure du montage qui devient alors celui de la figure 2 ci-après.
1.6.1) Comment s'appelle le montage de la figure 2 ?
Quel est son rôle?
1.6.2) A partir de 40 mL de linalol. on récupère 2,5 mL d'acétate de linalyle. Calculer le rendement de la synthèse.
1.7) Le rendement dans ces conditions expérimentales est mauvais. D'autre part, le linalol est un produit très coûteux.
1.7.1) Que proposeriez-vous pour améliorer le rendement, sans changer la nature des réactifs ?
1.7.2) Que proposeriez-vous pour améliorer le rendement, en changeant l'un des réactifs?
2) Séance n°2 : preparation du savon.
Les savons durs sont des carboxylates de sodium que nous représenterons par la formule générale RCOONa où R est une chaîne carbonée linéaire comportant de 10 à 20 atomes de carbone.
Ils sont préparés par action de la soude (solution aqueuse d'hydroxyde de sodium) sur les corps gras qui sont des triesters du glycérol.
Le glycérol a pour formule semi-développée CH2OH–CHOH–CH2OH.
2.1) Ecrire la formule semi développée générale d'un corps gras.
2.2) En utilisant les formules semi-développées, écrire l'équation de la réaction entre un corps gras et la soude.
2.3) Quelles sont les caractéristiques de cette réaction ?
On prépare ce savon à partir d'huile d’olive, corps gras qui est principalement composé d'oléine.
Résumé du mode opératoire :
Après un chauffage à reflux des réactifs pendant 30 minutes, en présence d'éthanol qui permet d'homogénéiser le mélange, on refroidit le ballon puis on verse le mélange dans une solution saturée de chlorure de sodium. Après quelques instants, le savon précipite en surface.
On le filtre sous vide, on le rince à l'eau froide et on le sèche.
Données :
|
Nom de l’espèce chimique |
Oléine |
Oléate de sodium |
|
Solubilité dans l’eau |
très faible |
faible |
|
Solubilité dans l'eau salée saturée |
très faible |
très faible |
|
solubilité dans l'éthanol |
très grande |
très faible |
L’eau, l'éthanol et le glycérol sont miscibles en toutes proportions.
2.4) A l'aide du tableau, expliquer pourquoi on utilise de l’eau salée.
3) Phase finale.
Dans un bécher, les élèves mélangent le savon fraîchement préparé avec l'acétate de linalyle puis ils ajoutent 3 gouttes de jaune d'alizarine "G" qui est un indicateur coloré acido-basique.
On obtient une couleur mauve rappelant celle de la lavande. Les élèves déposent le mélange dans un petit moule en papier confectionné pour l'occasion et laissent sécher.
Une semaine plus tard, le mini savon est démoulé et les élèves constatent le réalisme du savon obtenu : odeur, couleur, propriétés détergentes.
Pourtant le professeur déconseille fortement aux élèves de se servir de ce savon pour se laver.
Pourquoi une telle réaction du professeur après une réalisation de longue haleine menée avec enthousiasme par les élèves ?
Donnée :
zone de virage et teintes
du jaune d'alizarine G:
©Sciences Mont Blanc
Amérique du Sud Novembre 2004 - I ) Comment
accorder une guitare (spe):
L'annexe, page 9, est à rendre avec la copie
I ) Avec un accordeur électronique :
Les guitaristes emploient plusieurs méthodes pour accorder leur guitare. La plus simple consiste à utiliser un accordeur électronique dont le principe de fonctionnement s'apparente à un microphone relié à un fréquencemètre par l'intermédiaire d'un amplificateur. Chaque corde dite "à vide" vibre entre le sillet et le chevalet, distants d'une longueur L. La corde est pincée puis accordée indépendamment des autres en tournant la clef correspondante située en haut du manche (voir figure 1), ce qui ajuste sa tension. Lorsque la guitare est accordée, chaque corde à vide produit, lorsqu'elle est pincée, une note correspondant à son nom. On parle alors de corde de mi grave, corde de la, corde de sol, etc. (voir figure 2). Le tableau 3 précise la correspondance entre la note produite par chaque corde et la fréquence de la tension périodique mesurée par le fréquencemètre. Les différentes cordes n'ont pas toutes la même masse linéique et on peut considérer qu'elles sont toutes tendues de la même façon.


tableau 3
|
corde de |
mi grave |
la |
ré |
sol |
si |
mi aigu |
|
fréquence (Hz) |
329,63 |
440,00 |
587,33 |
783,99 |
987,77 |
1318,50 |
1) Quel est le rôle de la table d'harmonie dans une guitare (voir figure 1) ?
2) Quelle grandeur physique est associée à la hauteur d'une note ?
3) Etude des paramètres dont dépend la hauteur de la note.
a) Ecrire la condition d'existence d'une onde stationnaire entre deux obstacles fixes séparés par une longueur L. En déduire l'expression de la longueur d'onde l du mode fondamental.
b) Ecrire la relation entre la longueur d'onde l, la célérité v et la période T d'une onde sinusoïdale.
La célérité v des ondes le long d'une corde tendue entre deux points fixes est donnée par l'expression :
v = ![]() (F/ m) avec F = tension de la corde en Newton et m =masse
linéique en kg.m-1.
(F/ m) avec F = tension de la corde en Newton et m =masse
linéique en kg.m-1.
c) En utilisant les résultats des questions 3)a) et 3)b), montrer que la période du son émis vaut :
T = 2 L
![]() (m/
F)
(m/
F)
4) L'accordeur électronique indique que la corde de la a une hauteur trop basse lorsqu'elle est pincée. Quelle manipulation le guitariste doit-il faire pour accorder la corde de la ?
Justifier, sans calcul, en vous aidant de l'expression donnée à la question 3)c).
II ) Vérifier l'accord avec les harmoniques :
Pour vérifier le bon accord entre les différentes cordes, le guitariste utilise une technique qui consiste à exciter les cordes sur des modes propres tels que 2 cordes à vide adjacentes produisent la même note. Par exemple, pour vérifier l'accord entre les deux premières cordes, le musicien procède comme suit :
- après avoir pincé la corde de la, il pose délicatement et brièvement le doigt sur la corde, sans appuyer sur celle-ci, au niveau de la frette n°7, c'est à dire au premier tiers de la distance sillet-chevalet L.
- presque simultanément, il refait la même chose avec la corde de mi grave en posant son doigt au niveau de la frette n°5, c'est à dire au premier quart de la distance sillet-chevalet L (voir figure 2 de la page 2 et la figure 4 de la feuille annexe page 9).
Les deux cordes doivent alors produire la même note.
La figure 4 de l'annexe page 9 (à rendre avec la copie) représente les trois premiers modes propres d'une corde tendue entre le sillet et le chevalet de la guitare.
1) Comment s'appelle le premier mode propre ? Comment s'appellent les autres modes propres ?
2) Sur le troisième mode de la figure 4 de l'annexe, préciser les positions des nœuds et des ventres de vibration
3) Sans souci d'échelle pour l'amplitude, représenter sur les lignes A, B, C de la figure 4 de l'annexe, l'allure des trois modes propres d'ordre n immédiatement supérieur.
4) Compléter le tableau 4 de l'annexe donnant les fréquences associées aux 6 premiers modes propres des cordes de mi grave et la.
5) Quels modes de vibration le guitariste supprime-t-il lorsqu'il pose son doigt au niveau de la frette n°5 ? Même question lorsqu'il pose son doigt au niveau de la frette n°7 ( on pourra s'aider de la figure 4).
6) Quelle est la fréquence commune du son obtenu sur les deux cordes ? A quelle note correspond-elle ?
Annexe ( à rendre avec la copie )
figure 4
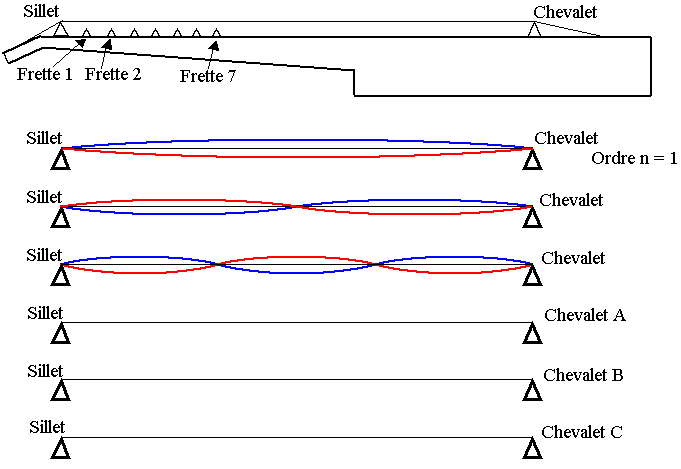
tableau 4
|
mode n°1 |
1 |
2 |
3 |
4 |
5 |
6 |
|
fréquence de la corde de mi grave (Hz) |
660 |
1650 |
1980 |
|||
|
fréquence de la corde de la (Hz) |
440 |
1320 |
1760 |
©Sciences Mont Blanc
