Sujet Bac France - Septembre 2005
Calculatrice non autorisée
I ) Traitement de l'eau d'une piscine (4 points)
II ) A propos du marquage isotopique (6,5 points)
III ) Le transit de Vénus du 8 Juin 2004 (5,5 points)
I ) (4 points) (spe)
France - Septembre 2005 - I ) Traitement de l'eau d'une piscine
:
Depuis plusieurs décennies, l'acide chlorhydrique et l'hypochlorite de sodium sont utilisés dans les piscines (1).
L'acide chlorhydrique régule l'acidité ou le pH, tandis que l'hypochlorite désinfecte à merveille. Tous deux constituent des garanties pour notre santé. Non seulement l'eau de la piscine est désinfectée mais, en plus, l'hygiène et la propreté des conduites et des filtres sont maintenues sur l'ensemble de son parcours.
L'hypochlorite de sodium est le désinfectant le plus utilisé. Les grandes piscines le stockent en vrac dans de grandes citernes, les plus petites dans des fûts.
Exceptionnellement, on rencontre une installation qui prépare ce produit sur place. Cela s'effectue par électrolyse de la saumure (solution aqueuse de chlorure de sodium), dont résulte du chlore gazeux. Après mélange avec de l'hydroxyde de sodium en solution, on obtient de l'hypochlorite de sodium.
D'après Le livre blanc du chlore, juillet 2003 (www.belgochlor.be)
(1) En milieu beaucoup plus acide que l'eau de la piscine, les ions hypochlorite et chlorure réagissent et donnent un dégagement de dichlore, gaz toxique.
Les parties 1 et 2 traitent de la fabrication de I'hypochlorite de sodium par électrolyse d'une solution de chlorure de sodium.
La partie 3 traite du principe de la régulation du pH d'une eau de piscine. Cette partie est indépendante des parties 1 et 2.
1 ) Electrolyse d'une solution aqueuse de chlorure de sodium au laboratoire
 Pour déterminer les produits
de l'électrolyse d'une solution de
chlorure de sodium, on réalise l'expérience suivante au laboratoire (voir
schéma simplifié de la Figure 1 ci-contre).
Pour déterminer les produits
de l'électrolyse d'une solution de
chlorure de sodium, on réalise l'expérience suivante au laboratoire (voir
schéma simplifié de la Figure 1 ci-contre).
Un tube en U contient une solution de chlorure de sodium (Na+(aq) + Cl–(aq) ).
Deux électrodes A et B sont reliées chacune à l'une des bornes (positive ou négative) d'un générateur de tension continue G.
Après plusieurs minutes de fonctionnement, on effectue des tests d'identification des produits formés.
- A une électrode, il s'est formé un dégagement de dichlore.
- A l'autre électrode, il s'est formé un dégagement de dihydrogène et il est apparu des ions hydroxyde HO –.
L'équation de la réaction modélisant l'électrolyse est :
2 H2O + 2 Cl – (aq) = H2 (g) + Cl2 (g) + 2 HO –(aq) (équation 1)
Données : couples oxydant/réducteur :
H2O / H2 (g) ; Cl2 (g) / Cl –(aq) ; O2 (g) / H2O ; ClO – (aq) / Cl2 (g)
1.1) A partir des indications de l'énoncé, identifier les deux couples oxydant/réducteur mis en jeu dans l'équation 1 modélisant l'électrolyse.
1.2) En déduire l'espèce chimique oxydée.
1.3) Identifier l'électrode (A ou B) à laquelle se produit l'oxydation. Quel gaz se dégage à cette électrode ?
2 ) Etude d'un électrolyseur pour piscine
Dans certaines piscines, on ajoute à l'eau de la piscine du chlorure de sodium. Après pompage, l'eau est traitée par électrolyse.
L'électrolyseur peut être représenté par une cellule comprenant deux électrodes et un coffret d'alimentation électrique délivrant une tension continue d'environ 10 V.
Données :
Intensité du courant : 20 A
On rappelle que la quantité Q d'électricité débitée pendant la durée Dt et l'intensité I du courant sont liées par la relation : I = Q / Dt.
Aide au calcul : NA.e = 1,0.105 C.mol–1 avec NA constante d'Avogadro et e charge élémentaire
2.1) Dans ce dispositif, l'électrolyse de la solution de chlorure de sodium est modélisée par l'équation 1 précédente :
2 H2O + 2 Cl – (aq) = H2 (g) + Cl2 (g) + 2 HO – (aq) (équation 1)
2.1.1) Compléter le tableau d'avancement fourni en Annexe à rendre avec la copie.
2.1.2) En déduire la relation entre la quantité n(e –), en mole, d'électrons échangés et la quantité n1(Cl2 )de dichlore formé lors de la réaction d'équation 1.
2.2) Dans cet électrolyseur, les ions hydroxyde et le dichlore formé sont consommés lors d'une nouvelle transformation chimique supposée rapide et totale, dont l'équation est la suivante :
Cl2 (g) + 2 HO – (aq) = ClO – (aq) + Cl – (aq) + H2O (équation 2)
Etablir la relation entre la quantité n(ClO–) d'ions hypochlorite formés et la quantité n2(Cl2) de dichlore consommé dans la réaction d'équation 2.
2.3) La transformation associée à l'équation 2 étant supposée totale et rapide, en déduire la relation entre n(e –) et n(ClO– ).
2.4) En déduire et calculer la quantité de matière maximale d'ions hypochlorite que peut fournir cet appareil, en une heure de fonctionnement.
3 ) Régulation du pH de l'eau de piscine
La régulation du pH est essentielle dans le traitement de l'eau des piscines.
En permanence analysé grâce à une sonde puis corrigé par une pompe (par injection de produit correcteur), le pH est maintenu automatiquement à son niveau idéal (7,2 – 7,6).
Données :
On considère toutes les solutions à 25°C
Couples acide/base :
H3O+(aq) / H2O ; pKA1 = 0 et H2O / HO–(aq) ; pKA2 = 14
acide hypochloreux/ion hypochlorite : HClO(aq) /CIO–(aq) ; pKA3 = 7,5
3.1) Lors d'un contrôle de pH, la sonde mesure la valeur pH = 8,5. Le pH de cette eau, plus élevé que celui de l'humeur aqueuse de l'œil humain, est responsable de l'irritation des yeux.
3.1.1) A ce pH, indiquer l'espèce prédominante du couple HClO(aq)/ClO–(aq).
3.1.2) Calculer le rapport des concentrations en ions hypochlorite et en acide hypochloreux lors de ce contrôle (on ne cherchera pas à déterminer ces deux concentrations).
3.2) Pour rétablir la valeur du pH au niveau "idéal", la pompe injecte 0,10 mol d'acide chlorhydrique dans l'eau de la piscine, sans variation notable du volume V de l'eau contenue dans la piscine. L'équation de la réaction associée à la transformation qui se produit est :
ClO–(aq) + H3O+(aq) = HClO(aq) + H2O (équation 3)
3.2.1) Exprimer la constante d'équilibre K de cette réaction en fonction de KA3. Calculer K.
3.2.2) L'état initial du système est défini ainsi :
- le volume de l'eau de la piscine est V = 1,0.105 L.
- on introduit 0,10 mol d'ions H3O+ par ajout d'acide chlorhydrique.
-le rapport [ClO-]i / [HClO]i est égal à celui calculé au 3.1.2)
3.2.2.a) Calculer la concentration molaire effective initiale en ions H3O+ notée [H3O+]i .
3.2.2.b) Calculer le quotient de réaction initial Qr,i.
3.2.3. En appliquant le critère d'évolution spontanée, donner le sens d'évolution de la réaction d'équation 3.
3.2.4) A partir de l'expression de la constante d'acidité KA3 du couple acide hypochloreux/ion hypochlorite et du rapport [ClO-]i / [HClO]i calculé au 3.1.2., montrer que le pH de l'eau de la piscine diminue.
Annexe Question 2.1.1.
|
Avancement |
2H2O(l) + 2 Cl–(aq) = H2 (g) + Cl2 (g) + 2 HO–(aq) |
Quantité (en mol) d'électrons échangés |
|||||
|
Etat initial |
0 |
excès |
n(Cl–)i |
0 |
0 |
0 |
0 |
|
Etat en cours de transformation |
x |
excès |
|||||
|
Etat final |
xf |
excès |
|||||
©Sciences Mont Blanc
France - Septembre 2005 - II ) A propos du marquage isotopique :
Le marquage isotopique consiste à remplacer dans la molécule que l’on désire étudier, un atome ou un groupe d’atomes par un atome radioactif de manière à pouvoir l’utiliser comme traceur.
Dans cet exercice on s’intéressera à deux applications de cette technique :
en physique avec une technique d’imagerie médicale ;
en chimie avec l’étude d’une réaction.
Les parties 1 et 2 sont indépendantes
1 ) Marquage isotopique et technique d’imagerie médicale :
En cancérologie, le traceur utilisé pour l’imagerie médicale est le glucose marqué par le fluor 18. Ce traceur s’accumule préférentiellement dans les cellules cancéreuses, grandes consommatrices de sucre. Cette technique se singularise par l’utilisation d’isotopes radioactifs dont le temps de demi-vie est beaucoup plus court que les produits classiques de la médecine nucléaire. Ainsi le fluor 18 a un temps de demi-vie radioactive de 110 minutes. Pour cette raison le traceur est fabriqué sur place de manière à ce qu’au moment de son injection au patient la dose administrée ait une activité de 260 MBq.
1.1) Désintégration du "fluor 18"
Le "fluor 18" ( 189F) est un isotope radioactif du fluor. Il est produit sur place dans le laboratoire d’imagerie médicale. Le "fluor 18" se désintègre spontanément pour donner l’isotope 18 de l’oxygène ( 188O). L’équation de cette réaction nucléaire peut s’écrire :
189F ® 188O + AZX
Donner la composition du noyau de l’isotope 18 du fluor.
En appliquant les lois de conservation déterminer Z et A. Cette désintégration est-elle du type a, b- ou b+ ?
1.2) Constante radioactive du "fluor 18"
Le laboratoire d’imagerie médicale est équipé d’un appareil qui permet de remplacer un groupement hydroxyle –OH du glucose par un atome de "fluor 18". Le nombre N de noyaux radioactifs de "fluor 18" encore présents varie en fonction du temps et suit une loi de décroissance exponentielle :
N = N0.e - l . t. La relation liant la constante radioactive et le temps de demi-vie est : t½ = ln 2 / l
1.2.1) Donner la définition du temps de demi-vie radioactive.
1.2.2) Par une analyse dimensionnelle, déterminer l’unité de l dans le système international.
A l’aide des données du texte encadré, choisir parmi les nombres suivants, celui qui permet d’évaluer l’ordre de grandeur de l.
10–4 10–3 10–2
Aide au calcul : ln2 = 6,9. 10-1
1.3) Activité du "fluor 18"
L’équipe du laboratoire d’imagerie médicale doit réaliser 2 examens dans la matinée sur deux patients différents. Deux doses de traceur contenant le même nombre N0 de noyaux radioactifs sont fabriquées en même temps avant leur injection pour réaliser ces examens. Au moment de son injection au patient la dose de traceur doit avoir une activité de 260 MBq.
Lors du premier examen on injectera la dose notée D1 à 9 h 00. On rappelle que l’activité A du "fluor 18" présent dans le traceur est reliée à la variation DN du nombre de noyaux radioactifs de cet isotope pendant une durée Dt par la relation :
A = – DN / Dt. (Si Dt est suffisamment petit, on peut écrire A = – dN/dt)
La mesure expérimentale de l’activité de chaque dose, toutes les vingt minutes, à partir de la date t = 0 min (instant de fabrication), a permis de tracer le graphe A = f(t) représentés sur la figure 2 de l'Annexe à rendre avec la copie.
On rappelle que : 1MBq = 106 Bq
1.3.1) Après avoir rappelé l’expression du nombre de noyaux radioactifs noté N encore présents à l’instant de date t, montrer que l’activité A de la source radioactive peut se mettre sous la forme : A = A0.e -l . t. Exprimer littéralement A0 en fonction de l et N0.
1.3.2) Calculer le nombre de noyaux de "fluor 18" présents dans la dose de traceur au moment de son injection au patient lors d’un examen médical. On donne l = 1.10–4 s-1
1.3.3) En s’aidant de la Figure 2 de l'annexe à rendre avec la copie , déterminer l’heure de la fabrication de la dose de traceur notée D1. A quelle heure le deuxième examen correspondant à l’injection de la dose notée D2 préparée en même temps que la dose D1 aura-t-il lieu ?
1.3.4) L’injection d’une dose a lieu à l’instant de date ti.
Calculer l’ordre de grandeur, exprimé en heures, du temps nécessaire après l’injection pour que l’activité soit 100 fois plus faible qu’au moment de l’injection.
Aide au calcul : ln 100 = 4,6 4,6 / 3,6 = 1,3
1.4) Méthode d’Euler
Il est souvent utile de prévoir les courbes de décroissance par une méthode de calcul, la méthode d’Euler par exemple, sans procéder à l’expérience.
A partir de la loi de décroissance A = A0.e -l . t, l’équation différentielle vérifiée par l’activité A du traceur est : dA/dt + l . A = 0.
La méthode d’Euler consiste à introduire les notations suivantes :
dA/dt = DA / Dt pour des intervalles de temps Dt très petits ;
A(tn+1) = A (tn) + DA(tn) avec tn+1 = tn + Dt et où Dt est appelé "pas de résolution".
1.4.1) Montrer que la relation de récurrence entre A(tn+1) et A(tn) peut se mettre sous la forme : A(tn+1) = (1 – l.Dt).A(tn).
1.4.2) A l’aide de la relation précédente, calculer en MBq la valeur de l’activité A(t1) à l’instant de date t1 = 100 s et la valeur de l’activité A(t2) à l’instant de date t2 = 200 s et vérifier sur la courbe de la figure 3 de la page suivante, la validité de ces résultats.
On prendra A0 = 800 MBq, Dt = 100 s et l » 1.10-4 s-1.
1.4.3) La validité de la méthode d’Euler est liée au choix du pas de résolution.
Quels sont l’intérêt et l’inconvénient du choix d’un pas de résolution Dt = 1 s dans cet exemple ?

2 ) Utilisation du marquage isotopique en chimie
Le salicylate de méthyle est le composant principal d’une huile essentielle naturelle appelée essence de wintergreen extraite par hydrodistillation des feuilles de gaulthérie, bruyère d’Amérique du Nord et de Chine. Doté d’une odeur caractéristique, il confère à cette huile essentielle des propriétés analgésique et anti-inflammatoire puissantes. Appliqué par voie cutanée sous forme de pommade, il est très apprécié des sportifs tant avant qu’après l’effort. Pour des raisons économiques le salicylate de méthyle est à l’heure actuelle synthétisé à partir de l’acide salicylique et du méthanol.

2.1) Synthèse du salicylate de méthyle au laboratoire
Dans un ballon on introduit 69 g d’acide salicylique, 32 g de méthanol, 1mL d’acide sulfurique et quelques grains de pierre ponce. On adapte le ballon au dispositif expérimental (montage à reflux) schématisé par la Figure 4 ci-contre et on chauffe le milieu réactionnel pendant deux heures sous hotte.
Données : masses molaires moléculaires
- acide salicylique M1 = 138 g.mol-1
- méthanol M2 = 32 g.mol-1

formule semi-développée de l’acide salicylique
2.1.1) Ecrire l’équation de la réaction modélisant la synthèse du salicylate de méthyle.
2.1.2) Nommer cette réaction et donner ses caractéristiques.
2.1.3) Préciser le rôle joué par l’acide sulfurique lors de cette réaction.
2.1.4) Indiquer la fonction des tubes 1 et 2 de la Figure 4 en précisant le sens de circulation du fluide. Quel est l’intérêt de ce montage ?
2.1.5) Quel est le réactif limitant ? Pourquoi n’a-t-on pas introduit les réactifs dans les proportions stœchiométriques ?
2.2) Première approche de la compréhension du mécanisme de la transformation grâce au marquage isotopique.
Le mécanisme de la réaction précédente n’est pas simple. Cependant la méthode expérimentale du marquage isotopique permet de comprendre quelles liaisons sont rompues. Une rupture est représentée ci-dessous d’une manière schématique par des pointillés.
On effectue la réaction avec un alcool, préparé spécialement, dans lequel l’oxygène est l’isotope 18O noté O* (au lieu de l’isotope le plus abondant 16O). On constate expérimentalement que cet oxygène « lourd » se retrouve au niveau des produits dans le salicylate de méthyle uniquement et que l’eau formée ne contient pas plus d’isotope 18O que l’eau naturelle.
On envisage les deux hypothèses suivantes :
|
Acide carboxylique |
Alcool |
|
|
Hypothèse 1 |
|
|
|
Hypothèse 2 |
|
|
Choisir l’hypothèse en accord avec les observations expérimentales. Justifier la réponse (l’équation de la réaction n’est pas exigée).
Annexe Question 1.3.3)
©Sciences Mont Blanc
France - Septembre 2005 - III ) Le transit de Vénus du 8 Juin 2004 :
Le transit d'une planète correspond à son passage entre la Terre et le Soleil. Pour un observateur terrestre cela se manifeste par la présence d'un disque sombre sur le fond brillant du Soleil.
Les transits de Vénus sont des phénomènes extrêmement rares.
On compte en effet environ 2 passages de Vénus devant le Soleil par siècle, mais aucun transit n'a eu lieu au cours du 20ème siècle. Au 19ème siècle les passages de la planète devant le disque solaire ont eu lieu en 1874 et en 1882. Au 21ème siècle, le même phénomène s'est reproduit très récemment le 8 juin 2004. Le prochain transit de Vénus aura lieu le 6 juin 2012 mais il ne sera pas observable depuis la France.

La figure 5 est un montage photographique réalisé, en France, par un astronome amateur. On voit sur le même cliché quelques positions de ce transit.
A partir de ce cliché et des données astronomiques fournies, l'astronome amateur désire mesurer la .vitesse orbitale de Venus
Quelques données astronomiques :
Soleil : Masse M1 = 2,0 x 10 30 kg
Distance moyenne à la Terre R1 = 1,5 x 10 8 km
Diamètre D1 = 1,4 x10 6 km
Vénus : Distance moyenne au Soleil R2 = 1,0 x 108 km
Masse notée M2
Constante de la gravitation : G = 6,6 x 10-11 SI
Pour les applications numériques il faut choisir dans les aides fournies la valeur appropriée au résultat attendu.
1) Etude des caractéristiques du mouvement de Vénus
Dans tout l'exercice on assimilera la Terre et Vénus à leur centre d'inertie.
L'astronome amateur considère que la planète Vénus tourne autour du Soleil sur une trajectoire circulaire dont le centre est le centre d'inertie du Soleil.
1.1) Comment nomme-t-on le référentiel d'étude ?
1.2) Nommer, exprimer vectoriellement puis représenter sur un schéma la force exercée par le Soleil sur la planète Vénus.
1.3) Dans le référentiel d'étude, appliquer à Vénus la deuxième loi de Newton (on négligera l'action des autres planètes sur Vénus). En déduire l'expression du vecteur accélération.
1.4) Etude théorique de la vitesse orbitale de Vénus
1.4.1) Le mouvement de la planète Vénus est uniforme.
Donner les caractéristiques du vecteur accélération de Vénus.
1.4.2) Retrouver, dans le référentiel choisi, l'expression de la vitesse de cette planète
v2 = ![]() (G.M1
/ R2)
(G.M1
/ R2)
1.4.3) En utilisant les données astronomiques fournies calculer, avec 2 chiffres significatifs, la valeur de cette vitesse.
Aide au calcul : ![]() 13 = 3,6
13 = 3,6
1.5) Etude de la période de Vénus
1.5.1) Définir la période de révolution T2 de la planète Vénus.
1.5.2) Exprimer cette période en fonction de la vitesse v2 et de la distance R2.
Calculer la valeur de cette période (en secondes). Aide au calcul : 2 p x 3,6 = 23 ; 2 p / 3,6 = 1,7
1.6) La 3ème loi de Kepler
1.6.1) A partir des réponses aux questions 1.4.2) et 1.5.2), retrouver la 3ème loi de Kepler.
1.6.2) Cette loi permet de déterminer la masse d'un astre central si les valeurs de la période et du rayon de l'orbite de l'un de ses satellites sont connues.
Exprimer littéralement la masse M1 du Soleil en fonction des données astronomiques nécessaires.
 2) Exploitation du transit de Vénus
2) Exploitation du transit de Vénus
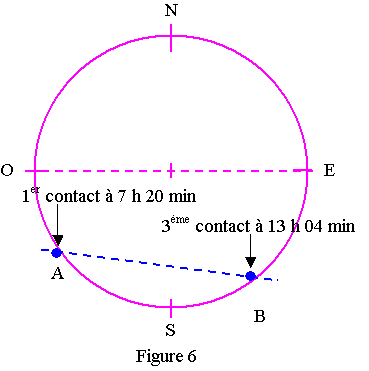
En France le 8 juin 2004, on a pu observer le début du transit de Vénus (appelé 1er contact) à 7 h 20 min et la fin du transit (appelé 3ème contact) à 13 h 04 min heure locale.
On prendra pour la durée de ce transit tAB = 2,0 x 104 s
La photographie donnée en introduction (Figure 5) est remplacée par le schéma ci-contre plus facilement exploitable (Figure 6).
On appelle A et B les points à la périphérie du Soleil correspondant au 1er et au 3ème contact.
2.1) On admet que, sur la Figure 6, le rapport des distances AB / OE est égal à 3/4.
A l'aide des données astronomiques fournies calculer la distance AB à la surface du disque solaire.

2.2) La planète Vénus se déplace dans l'espace entre la Terre et le Soleil. A chaque instant la position de la Terre, celle de Vénus et celle de la tache repérée sur le disque solaire sont alignées (voir la Figure n°7 ci-contre).
2.2.1) Dans un premier temps, l'astronome amateur considère que pendant la durée du transit de Vénus la Terre reste immobile, à la position Q1 (voir Figure 7 ci-dessus), par rapport au Soleil.
En considérant que la durée écoulée entre le premier contact et le troisième contact est égale à tAB = 2,0 x 104 s, montrer que la vitesse de Vénus déterminée à partir de la figure n°7 est alors voisine de v1 » 18 km.s-1 (valeur inférieure à la valeur v2 calculée en 1.4.3). On assimilera les segments A'B' et AB à deux segments parallèles.
2.2.2) Pour expliquer cette différence entre les deux valeurs calculées l'astronome amateur veut vérifier s'il était légitime de considérer la Terre immobile à la position Q1 pendant la durée du transit.
Sachant que la Terre se déplace sur son orbite à le vitesse de 30 km.s–1 calculer la distance Q1Q2 parcourue par la Terre sur son orbite pendant la durée tAB. La comparer à la distance AB et montrer qu'on ne peut considérer la Terre immobile durant cette période.
2.2.3) Si durant la durée tAB la Terre se déplace de la position Q1 à la position Q2 , la planète Vénus se déplace de la position A' à la position B" différente de B'.
Sur la Figure 8 de l'annexe à rendre avec la copie placer le point B" pour montrer que la distance A'B" réellement parcourue par Vénus pendant la durée de l'occultation est supérieure à A'B'.
On peut ainsi retrouver par calcul la valeur de la vitesse orbitale de Vénus donnée dans les tables astronomiques, soit 35 km.s-1.
Annexe

©Sciences Mont Blanc
France - Septembre 2005 - I ) (spe)
©Sciences Mont Blanc


