Sujet Bac Polynésie Juin 2005
Calculatrice autorisée
I ) Etude d'un circuit RC - Principe de fonctionnement d'une minuterie (7,5 points)
III ) Etude d'un produit ménager (4 points)
III ) Titrage des ions chlorure présents dans un anti-diarrhéique (4 points)
Polynésie Juin 2005 - I ) Etude d'un circuit RC -
Principe de fonctionnement d'une minuterie :
L'objet de cet exercice est d'étudier le principe de fonctionnement d'une minuterie permettant d'éteindre une lampe automatiquement au bout d'une durée t0 réglable.
Le montage du circuit électrique est constitué :
- d'un générateur idéal de tension, de force électromotrice E = 30 V.
- d'un interrupteur K.
- d'un conducteur ohmique de résistance R.
- d'un condensateur de capacité C.
- d'un bouton poussoir P qui joue le rôle d'un interrupteur ; il est fermé seulement quand on appuie dessus.
- d'un composant électronique M qui permet l'allumage de la lampe L tant que la tension aux bornes du condensateur, notée Ul (dans tout l'exercice on fixera Ul à une valeur constante égale à 20 V).
Le composant électronique M possède une alimentation électrique propre ( non représentée sur le schéma) qui lui fournit l'énergie nécessaire à l'allumage de la lampe.
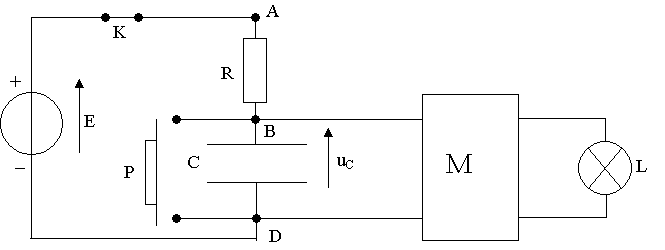
De ce fait, on admettra que le composant électrique M ne perturbe pas le fonctionnement du circuit RC, c'est à dire que la tension aux bornes du condensateur est identique que M soit présent ou non dans ce circuit.
I ) Etude du circuit RC :
A l'instant initial (t = 0s), le condensateur est déchargé. On ferme l'interrupteur K, le bouton poussoir P est relâché (voir schéma ci-dessus).
1) On souhaite visualiser les variations de la tension uC aux bornes du condensateur en fonction du temps à l'aide d'un oscilloscope à mémoire.
Indiquer les branchements à réaliser (voie 1 et masse) sur le schéma du document 1 de l'annexe à rendre avec la copie).
2) Montrer que l'équation différentielle donnant les variations de la tension uC(t) aux bornes du condensateur en fonction du temps est de la forme :
uC(t) + R.C.duC(t)/dt = E
3) a) En vérifiant que la fonction du temps uC(t) = A.(1 – e – t / t ) est solution de l'équation différentielle précédente montrer
que A = E et t = R.C
b) Quelle est la valeur de uC en régime permanent ?
c) Quel est le nom donné à la constante t ?
A l'aide d'une analyse dimensionnelle, donner l'unité de la constante t.
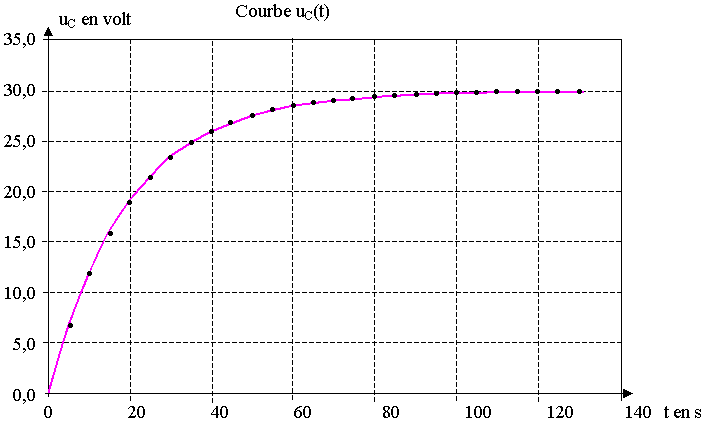
4) La représentation graphique de la fonction uC(t) est donnée dans le document 2 de l'annexe à rendre avec la copie.
Faire apparaître sur ce graphe sans aucune justification :
la tension E , la constante t et les régimes permanent et transitoire.
5) Calculer la valeur de la constante t pour R = 100 kW et C = 200 mF.
6) a) Donner l'expression littérale de la date t0 à laquelle la tension aux bornes du condensateur atteint la valeur limite Ul en fonction de Ul, E et t. (t0 est la durée d'allumage de la lampe).
b) Calculer la valeur de t0 et vérifier la validité du résultat à l'aide du graphe uC(t) fourni dans le document 2 de l'annexe à rendre avec la copie.
c) On a fixé Ul à 20 V pour obtenir une durée d'allumage t0 voisine de t. Pour quelle raison choisir t0 très supérieur à t n'aurait pas été judicieux pour un tel montage ?
7) Quel(s) paramètre(s) du montage peut-on modifier sans changer le générateur afin d'augmenter la durée d'allumage de la lampe ?
En fixant C = 200 mF quelle valeur doit-on donner à la résistance R pour obtenir une constante de temps d'une minute ?
8) On appuie sur le bouton poussoir. Que vaut la tension aux bornes du condensateur ?
La comparer à Ul . Que se passe-t-il pour la lampe dans les cas suivants :
a) la lampe est déjà allumée ?
b) la lampe est éteinte ?
II ) Méthode d'Euler :
On se propose maintenant de résoudre numériquement l'équation différentielle établie à la question I ) 2) , R et C conservant les valeurs R = 100 kW et C = 200 mF.
1) A partir de cette équation différentielle, donner la relation entre la dérivée (duC(t)/dt) et la tension uC(t).
La méthode d'Euler permet de calculer successivement les valeurs de uC(t) et de (duc(t)/dt) à un intervalle de temps régulier Dt appelé le pas.
En prenant un pas suffisamment petit, on peut écrire la relation :
uC(t + Dt) = uC(t) + (duc(t)/dt).Dt
Pour cette étude, on prend un pas égal à : Dt = 2 s.
2) En utilisant l'expression littérale ci-dessus, compléter dans le tableau donné en annexe (document 3) les colonnes correspondant aux dates t = 2 s et t = 4 s.
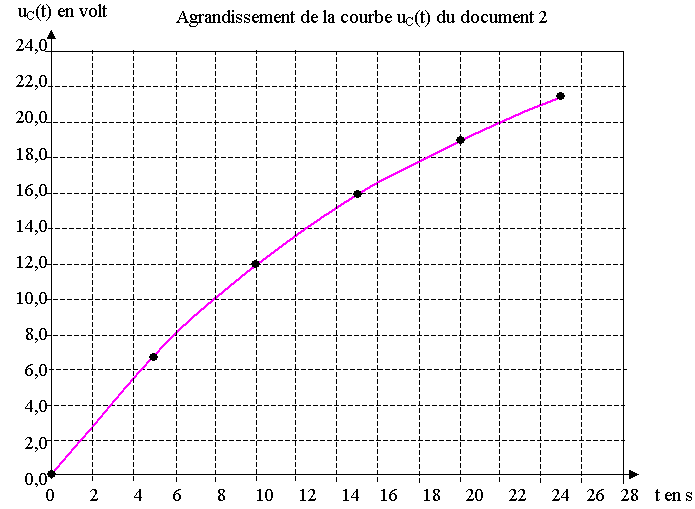
3) Le document 4 de l'annexe représente un agrandissement de la courbe uC(t) du document 2. Tracer sur ce document à rendre avec la copie, la partie du graphe uC(t) correspondant à ce tableau. Que constatez-vous ?
4) On peut améliorer la précision de la méthode d'Euler en modifiant la valeur du pas Dt.
Quelle modification pourrait-on apporter à la valeur du pas Dt ?
Quel serait l'inconvénient de cette modification ?
Annexe à rendre avec la copie
Document 1 :

Document 2 :
Document 3 :
|
t(s) |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
... |
20 |
|
uC(t) |
0 |
8,14 |
10,3 |
12,3 |
14,1 |
… |
19,6 |
||
|
duC(t)/dt |
1,50 |
1,09 |
0,99 |
0,89 |
0,80 |
… |
0,52 |
Document 4 :
©Sciences Mont Blanc
Polynésie Juin 2005 - II ) Parlons CD:
I ) Lumière émise par un laser :
On dispose d'une diode laser S émettant un faisceau lumineux monochromatique de longueur d'onde l = 0,790 mm.
1) Quelle est la couleur de la lumière émise par cette diode laser ?
2) La lumière émise résulte d'une transition entre deux niveaux d'énergie E1 et E2 tels que E2 < E1 Calculer en électronvolts l'écart énergétique E = E1 – E2 entre ces deux niveaux.
Données : Célérité de la lumière dans le vide c = 3,00.108 m.s-1 ,
Constante de Planck h = 6,63.10-34 J.s ,
1 eV = 1,60.10-19 J.
II ) Caractère ondulatoire de la lumière :
La lumière émise par la source S traverse une fente fine rectangulaire verticale de largeur
d = 0,10 mm.
Un phénomène dû à la nature ondulatoire de la lumière est observé sur un écran placé à une distance D = 2,0 m de la fente.
1) Quel est le nom de ce phénomène ?
2) Décrire qualitativement ce que l'on observe sur l'écran.
3) Toutes les autres grandeurs restent inchangées, comment est modifiée la figure observée sur l'écran si :
a) on diminue la largeur de la fente ?
b) on diminue la longueur d'onde ?
Justifier les réponses.
III ) Application à la lecture d'un CD :
Dans un lecteur CD on lit les informations gravées sur le disque sous forme de petites cuvettes réfléchissantes dont le diamètre limite le nombre d'informations. Actuellement on éclaire le disque avec une diode laser de longueur d'onde l = 0,790 mm.
Prochainement, on va commercialiser des lecteurs utilisant une diode laser émettant une longueur d'onde dans le bleu (lecteurs "blu-ray disc").
D'après la question II 3) b) quel intérêt présente ce changement de longueur d'onde ?
IV ) Gravure d'un CD :
La duplication en grande quantité d'un disque compact se fait par pressage de polycarbonate fondu à l'aide d'une matrice en nickel.
Le procédé se déroule en trois étapes :
1ère étape : Fabrication du glassmaster
Elle consiste à graver le disque de base (glassmaster) à partir duquel on va réaliser une duplication en série. On recouvre ensuite le glassmaster gravé d'une fine couche d'argent.
On obtient alors le glassmaster métallisé.
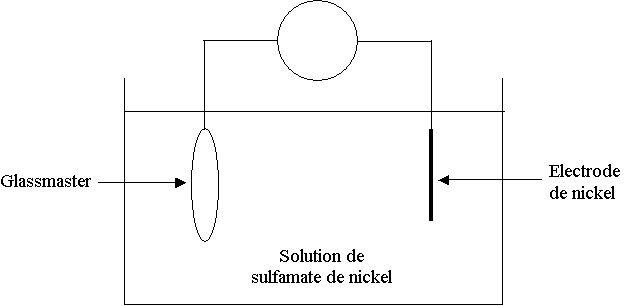
2ème étape : Galvanoplastie :
Elle consiste à créer une matrice, image symétrique du glassmaster. Ce dernier, étant devenu conducteur après le dépôt d'argent, est immergé pendant 2 heures dans une solution acide de sulfamate de nickel où il va subir une électrolyse, l'autre électrode étant du nickel.
Le but de cette opération est de créer un dépôt de nickel sur le glassmaster.
On sépare ensuite cette couche de nickel et on obtient une matrice, le père, qui est une image symétrique parfaite du glassmaster.
3ème étape : Le pressage :
On place le père dans le moule d'une presse qui permet de dupliquer le disque en grand nombre.
Les questions qui suivent ne portent que sur la 2ème étape (galvanoplastie).
1) Sur le schéma de l'électrolyse donné en annexe à rendre avec la copie, préciser le sens du courant et la polarité des bornes du générateur, en justifiant votre réponse.
2) Nommer les électrodes et préciser les équations des réactions qui s'y déroulent.
3) Le père obtenu est un disque de nickel de 23,0 cm de diamètre et de 3,05.10-1 mm d'épaisseur.
a) Vérifier que la masse du père est m = 113 g.
b) En déduire la quantité de matière de nickel déposée lors de l'électrolyse.
4) L'électrolyse dure 2 heures. Quelle doit être la valeur de l'intensité du courant qui circule dans le circuit ?
Données : Couple oxydant / réducteur : Ni2+ / Ni
Masse volumique du nickel : r = 8,90 g.cm-3
Masse molaire du nickel : M = 58,7 g.mol-1
Charge élémentaire : e = 1,60.10-19 C
Le nombre d'Avogadro NA = 6,02.1023 mol-1
Annexe ( à rendre avec la copie )
©Sciences Mont Blanc
Polynésie Juin 2005 - III ) Etude d'un produit ménager
:
L'ammoniac, NH3 est un gaz qui, dissout dans l'eau, donne une solution basique d'ammoniaque.
Des solutions d'ammoniaque sont vendues dans le commerce.
Ces solutions, après dilution, sont utilisées comme produit nettoyant et détachant.
On se propose d'étudier quelques propriétés de l'ammoniac dissout puis de déterminer sa concentration dans un de ces produits.
Données relatives à l'exercice :
Masse molaire de l'ammoniac : M(NH3) = 17 g.mol-1 ,
Constante d'acidité du couple ion ammonium/ammoniac à 25°C : KA1 = 6,3.10-10 ,
Constante d'acidité du couple H2O / HO- à 25°C : KA2 = 1,0.10-14 .
I ) NH3 (aq) :
1) L'ammoniac est une base en solution aqueuse.
a) Donner la définition d'une base selon Brönsted
b) Ecrire l'équation de réaction entre l'ammoniac et l'eau.
c) Exprimer et calculer la constante d'équilibre de cette réaction.
2) On dissout dans un volume d'eau V égal à 250 mL une quantité de matière n d'ammoniac égale à 2,5.10-3 mol. Le pH de la solution S obtenue vaut 10,6.
a) Calculer la concentration c en soluté ammoniac apporté.
b) Calculer la concentration en ion oxonium, H3O+ , dans la solution.
c) En déduire la concentration en ion hydroxyde, HO-, dans la solution.
d) Montrer que le taux d'avancement final t peut s'écrire t = [HO-]f / c , puis le calculer.
(On pourra utiliser un tableau descriptif de l'évolution du système).
e) Que peut-on dire de la transformation?
II ) Détermination de la concentration en ammoniac de la solution commerciale :
1) Dilution de la solution commerciale
Afin de déterminer la concentration c0 de la solution commerciale, on propose de réaliser un titrage acido-basique de la solution commerciale. Celle-ci étant très concentrée, on fabrique par dilution, une solution S1 de concentration c1 mille fois plus petite.
Parmi les lots de verrerie proposés, choisir, en justifiant, celui que l'on doit utiliser pour réaliser au mieux cette dilution.
|
Lot 1 |
Lot 2 |
Lot 3 |
Lot 4 |
|
Pipette jaugée 1 mL Bécher 100 mL Bécher 50 mL |
Pipette jaugée 10 mL Fiole jaugée 1 L Bécher 50 mL |
Pipette jaugée 1 mL Fiole jaugée 1 L Bécher 50 mL |
Pipette jaugée 10 mL Fiole jaugée 1 L Bécher 50 mL |
2) Titrage acido-basique de la solution diluée
On réalise un titrage pH-métrique de V1 = 20,0 mL de solution diluée S1 par une solution d'acide chlorhydrique (H3O+(aq) + Cl-(aq)) de concentration cA = 1,50.10-2 mol.L-1 .
L'équation support du titrage est : NH3 (aq) + H3O+(aq) = NH4+(aq) + H2O(l)
Pour obtenir l'équivalence il a fallu verser un volume VAE = 14,3 mL d'acide chlorhydrique.
On note que le pH à l'équivalence vaut 5,7.
a) Définir l'équivalence d'un titrage.
b) Etablir la relation à l'équivalence entre c1, cA, V1, VAE où VAE est le volume de solution acide versé à l'équivalence. (On pourra utiliser un tableau descriptif de l'évolution du système chimique).
c) En déduire c1 puis c0.
d) Parmi les indicateurs colorés suivants, choisir, en justifiant, celui qui pourrait être utilisé pour réaliser ce titrage de façon colorimétrique.
|
Indicateur coloré |
Couleur forme acide |
Zone de virage |
Couleur forme basique |
|
hélianthine |
rouge |
3,1 – 4,4 |
jaune |
|
rouge de chlorophénol |
jaune |
5,2 – 6,8 |
rouge |
|
bleu de bromothymol |
jaune |
6,0 – 7,6 |
bleu |
|
phénolphtaléine |
incolore |
8,2 - 10 |
rouge violacé |
©Sciences Mont Blanc
Polynésie Juin 2005 - III ) Titrage des
ions chlorure présents dans un anti-diarrhéique (spe):
Documents :
La diarrhée entraîne une perte d'eau. Il faut empêcher cette perte hydrique par des apports de liquides.
L'eau pure ne suffit pas. En effet, la déshydratation est le résultat non seulement d'une perte en eau mais aussi en électrolytes (sels minéraux : sodium, potassium, chlorure, bicarbonates etc.).
Il faut donc apporter non seulement de l'eau mais aussi des électrolytes.
L'eau et les électrolytes vont empêcher la déshydratation mais ne nourrissent pas l'enfant. Il a besoin d'énergie, de calories. L'eau salée et sucrée est l'élément de base pour le réhydrater.
L'O.M.S. a mis au point une formule plus élaborée dont on trouve dans le commerce plusieurs équivalents : Adiaril®, GES 45 ®, etc…
L'adiaril® est une préparation de régime pour réhydrater les enfants en cas de diarrhée.
Ce produit ne contient ni lait, ni protéine de lait, ni gluten. On dilue chaque sachet de 7 g dans l'eau pour obtenir 200 mL de solution.
Composition de l'Adiaril® (extrait du tableau figurant sur la boîte ) :
|
Pour un sachet de 7 g (soit 200 mL de solution) |
|
|
Glucose |
2,65 g |
|
Saccharose |
2,49 g |
|
Sodium |
0,274 g |
|
Potassium |
0,156 g |
|
Chlorure |
0,210 g |
|
Citrate |
0,376 g |
|
Gluconate |
0,778 g |
I ) première partie :
Mise en évidence de la réaction support du titrage :
Dans un tube à essais A contenant V1 = 2,0 mL de solution aqueuse de chlorure de sodium (Na+(aq) + Cl-(aq)) de concentration
c1 = 5,00.10-2 mol.L-1 , on ajoute V1 = 2,0 mL de solution de nitrate d'argent ( Ag+(aq) + NO3-(aq)) de concentration
c = 4,25.10-2 mol.L-1 et on observe la formation d'un précipité blanc.
Questions :
1) Ecrire l'équation de la seule réaction ayant lieu dans le tube à essais A.
2) Exprimer littéralement le quotient de réaction Qr pour la réaction ainsi écrite.
3) Calculer le quotient de réaction Qr,i dans l'état initial fictif où les réactifs seraient en contact sans avoir réagi.
4) Sachant que la valeur de la constante d'équilibre à 25°C est K = 6,4.109, commenter le sens d'évolution de la transformation observée.
II ) Deuxième partie :
On se propose de vérifier la masse d'ions chlorure dans un sachet.
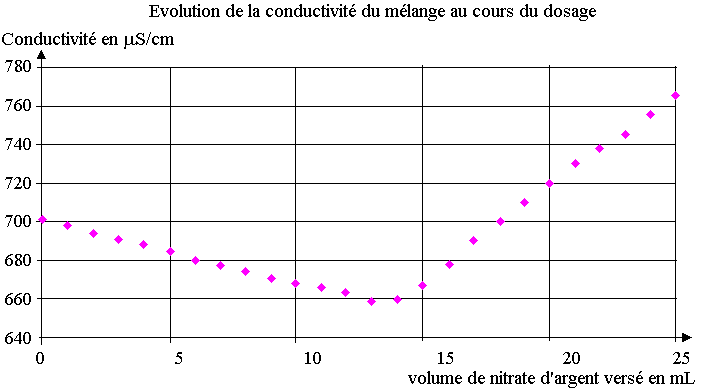
Pour cela, on décide de réaliser un titrage par conductimétrie. On dissout un sachet d'Adiaril® dans V= 200 mL d'eau. On prélève V2 = 20,0 mL de cette solution (S) que l'on place dans un bécher et on ajoute 200 mL d'eau distillée. On plonge dans le milieu une cellule de conductimétrie et on mesure la conductivité du mélange après chaque ajout de solution de nitrate d'argent de concentration c = 4,25.10-2 mol.L-1 . On obtient le graphe donné en annexe 3 à rendre avec la copie.
1) A propos du protocole :
1.1) Quelle verrerie utiliseriez-vous pour préparer la solution de 200 mL d'Adiaril® ?
1.2) Quelle verrerie utiliseriez-vous pour prélever V2 = 20,0 mL de solution ?
2) On donne les conductivités ioniques molaires des ions présents dans la solution d'Adiaril® :
|
Ion |
Sodium |
Potassium |
Chlorure |
Citrate |
Gluconate |
Argent |
Nitrate |
|
Formule |
Na+ |
K+ |
Cl- |
Ci3- |
gluc- |
Ag+ |
NO3- |
|
l conductivité ionique molaire en mS.m2.mol-1 |
5,01 |
7,35 |
7,63 |
21,0 |
1,50 |
6,19 |
7,14 |
Pendant le titrage, on négligera les variations de volume de la solution.
2.1) Avant l'équivalence
a) Exprimer littéralement la conductivité s1 du mélange.
b) Cette conductivité peut aussi s'écrire sous la forme s1 = B + D1 avec B terme pratiquement constant et D1 terme variable au cours du titrage.
Quels sont les ions dont la conductivité participe à l'expression des termes B et D1 ?
c) En déduire que la conductivité du mélange diminue faiblement avant l'équivalence.
2.2) Après l'équivalence :
a) Exprimer littéralement la conductivité s2 du mélange.
b) Cette conductivité peut aussi s'écrire sous la forme s2 = B + D2 avec B terme pratiquement constant et D2 terme variable au cours du titrage.
Quels sont les ions dont la conductivité participe à l'expression des termes B et D2 ?
c) En déduire que la conductivité du mélange augmente nettement après l'équivalence ?
3) Exploitation :
3.1) Déterminer sur le graphe donné en annexe 3 , le volume de la solution nitrate d'argent versé à l'équivalence.
3.2) En déduire la concentration des ions chlorure présents dans la solution (S).
3.3) En déduire la masse mexp d'ions chlorure dans le sachet.
3.4) Comparer votre résultat à celui lu sur l'étiquette mlue en calculant l'erreur relative.
½mexp – mlue ½ / mlue .
Donnée : Masse molaire atomique du chlore : 35,5 g.mol-1
Annexe 3 ( à rendre avec la copie)
©Sciences Mont Blanc



