Sujet Bac Liban - Juin 2006 - Calculatrice autorisée
I ) La logan au banc d'essai (mécanique) - (électricité) (9 points)
II ) Teneur en CO2 d'un vin (3 points)
III ) pH d'un mélange (4 points)
I ) ( points) (spe)
Liban - Juin 2006 - I ) La logan au banc d'essai : (mécanique)
La Dacia Logan, conçue par le constructeur français Renault est produite au départ en Roumanie.
Elle a fait la une de l'actualité lors de son lancement commercial : elle était en effet présentée comme «la voiture à 5000 euros ». Même si son prix fut finalement plus élevé que prévu, les journalistes automobiles étaient impatients d'évaluer cette voiture d'un nouveau genre.
L'exercice propose de détailler certains tests routiers effectués par les essayeurs d'un magazine automobile et d'étudier un composant du système d'alimentation en gazole du moteur Diesel qui peut équiper la Logan.
Donnée: Accélération de la pesanteur: g = 9,8 m.s-2.
Les parties A et B sont indépendantes.
PARTIE A: Performances et comportement routier
Les paragraphes I, II et III sont indépendants.
I ) Mesures de reprises
Le test consiste à faire passer la voiture, en pleine accélération et sur le deuxième rapport de la boite de vitesses, de 30 km.h-1 à 70 km.h-1 sur une portion de circuit rectiligne et horizontale.
On mesure alors le temps nécessaire à cette accélération, ce qui donne une bonne indication de la capacité du véhicule à s'insérer et à évoluer dans le trafic routier.
Résultat du test d'accélération donné par le magazine : passage de 30 km.h-1 à 70 km.h-1 en 5,4 s
1) Le vecteur accélération est supposé constant pendant tout le mouvement; sa norme est notée a1. Le schéma ci-dessous donne les différentes conventions utilisées. L'origine des temps est choisie à l'instant où le centre d'inertie G du véhicule passe au point O avec la vitesse v0 = 30 km.h-1.
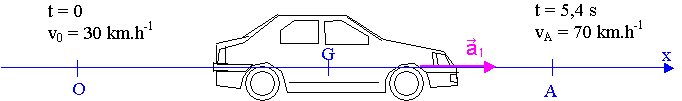
a) Donner la relation entre le vecteur accélération a1 et le vecteur vitesse v du centre d'inertie G du véhicule. En déduire l'équation horaire de la vitesse du centre d'inertie du véhicule v(t) en fonction de a1 ,v0 et t.
b) En utilisant le résultat du test d'accélération, montrer que la valeur de l'accélération a1 du véhicule en unités SI est a1 = 2,1 m.s-2.
2) a) Etablir l'équation horaire de la position x(t) du centre d'inertie G en fonction des grandeurs de l'énoncé.
b) En déduire la distance D parcourue par la Logan quand elle passe de 30 km.h-1 à 70 km.h-1 ,en 5,4 s.
II ) Virage sur une trajectoire circulaire
Un second test consiste à faire décrire à la voiture une trajectoire circulaire de rayon R = 50 m. Ce test donne une bonne indication de la tenue de route du véhicule.
Une chronophotographie (en vue du dessus) représentant les positions successives du centre d'inertie G de la Logan pendant ce test est donné en annexe page 10 à rendre avec la copie (Figure 1). La durée t = 1,00 s sépare deux positions successives du centre de masse G.
1) a) Exprimer les normes des vitesses v3 et v5 du centre d'inertie G aux points G3 et G5 en fonction des distances G2G4, G4G6 et de la durée t.
b) En utilisant la figure 1 montrer que ces vitesses v3 et v5 ont la même valeur d'environ 40km.h-1
c) Représenter les vecteurs vitesse v3 et v5 sur la figure 1 (échelle : 1 cm pour 2 m.s-1).
d) Représenter le vecteur Dv4 = v5 - v3 .
2) a) Donner l'expression du vecteur accélération a4 au point G4, en fonction de Dv4 et t.
b) Calculer la valeur de a4 en unité SI.
3) a) Le constructeur qualifie cette accélération de « latérale ».
Quel autre qualificatif utiliserait-on plutôt en physique?
b) Peut-on considérer que, pour les passagers de la voiture, l'effet de cette accélération est négligeable devant celui de l'accélération de la pesanteur ?
 III ) Suspension
III ) Suspension
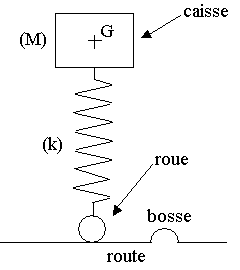
La Logan est constituée d'une caisse métallique reposant sur ses roues par l'intermédiaire d'une suspension, formée d'un ensemble de quatre ressorts avec amortisseurs. On peut modéliser cette voiture par un pendule élastique vertical dont les oscillations sont amorties. La seule particularité de ce pendule est d'avoir la masse M (correspondant à la caisse) à l'extrémité supérieure du ressort de raideur k ; la mise en oscillation ayant lieu lorsque l'extrémité inférieure du ressort (correspondant à la roue) subit un déplacement vertical, par exemple lors d'un passage sur une bosse (dos d'âne).
1) On considère la caisse de la Logan de masse M = 1 095 kg à l'arrêt, sans passager. Le ressort est alors comprimé. On appelle ½Dl0½ la valeur absolue de la différence entre sa longueur à vide et sa longueur en charge.
a) Faire l'inventaire des forces qui s'exercent sur la caisse.
b) Trouver la relation entre ½Dl0½, M, k et g en appliquant le principe d'inertie.
2) Quatre essayeurs, de masse totale m = 280 kg, montent à bord de la Logan. La caisse s'affaisse d'une hauteur h = 3,0 x 10-2 m. La variation de la longueur du ressort en valeur absolue devient :
½Dl½ = ½Dl0½ + h.
a) En utilisant le résultat de la question 1.b) établir la relation k = m . g / h.
b) Déterminer la dimension de k.
c) Calculer la valeur numérique de k.
3) On note T0 la période propre les oscillations de la caisse de la Logan avec un essayeur, de masse m1 = 70 kg, sans passager. Montrer que T0 = 0,71 s.
4) Afin que le confort des passagers soit optimal lors du passage sur une bosse, les réglages de la suspension sont prévus pour que la caisse retrouve sa position initiale sans osciller.
a) L'essayeur prend le volant d'une Logan neuve et roule sur une bosse. Quel est le nom du régime oscillatoire observé ?
b) L'essayeur recommence l'expérience avec une Logan ayant déjà beaucoup roulé. Ses amortisseurs étant «fatigués », l'amortissement de la caisse est moins important. Prévoir le comportement de la caisse dans ce cas en utilisant le vocabulaire adapté.
5) A nouveau au volant de la Logan neuve, l'essayeur, de masse m1 = 70 kg, aborde maintenant un ralentisseur installé par une municipalité à l'entrée de l'agglomération. Il est constitué d'une série de bosses distantes d'une longueur D. Le pendule élastique qui modélise la voiture est donc soumis à une succession d'excitations : la caisse subit des oscillations forcées.
L'essayeur constate que l'amplitude des oscillations est beaucoup plus importante qu'au passage d'une seule bosse, la voiture devient plus difficile à contrôler et le conducteur doit ralentir.
a) Quel nom donne-t-on au phénomène observe par l'essayeur ?
b) Quelle doit être la période des excitations pour que ce phénomène ait lieu ?
c) Cette période est la durée Dt que met la voiture pour passer d'une bosse à l'autre.
Calculer la distance D nécessaire pour que le phénomène ait lieu a une vitesse v = 80 km.h-1
d) Ainsi construit, ce ralentisseur devrait obliger les conducteurs trop rapides à ralentir pour respecter la vitesse de 50 km.h-1 en agglomération. Mais y aurait-il un autre moyen d'éviter le phénomène ressenti lors du passage sur le ralentisseur ? Si oui, expliquer.
(On ne tentera pas l'expérience !)
Annexe à rendre avec la copie

©Sciences Mont Blanc
Liban - Juin 2006 - I ) La logan au banc d'essai : (éléctricité)
PARTIE B : « L'injecteur par rampe commune »
Malgré les tarifs modérés de la Logan, son moteur Diesel bénéficie d'une technologie de pointe : le système d'injection directe de gazole par rampe commune. L'élément essentiel est l'injecteur qui pulvérise en quelques fractions de seconde une très faible quantité de gazole directement dans la chambre de combustion où se produit l'explosion du mélange air-gazole.
On peut schématiser cet injecteur par un long tube creux, percé à son extrémité inférieure d'un très petit trou bouché par une aiguille. C'est par ce trou que pourra sortir le gazole lorsque l'aiguille sera déplacée vers le haut.
Pour déplacer cette aiguille métallique vers le haut, on utilise une bobine qui, lorsqu'elle est traversée par un courant électrique, se comporte comme un aimant et attire alors l'aiguille à elle. Dès que le courant est coupé, l'aiguille reprend sa position initiale et bouche à nouveau le trou.
Un laboratoire de recherche d'un constructeur concurrent demande à un technicien d'étudier les caractéristiques de cette bobine.
I ) Prévision d'un dipôle bobine-conducteur ohmique :
 Pour préparer un protocole
d'étude de la bobine de l'injecteur, le technicien choisit d'abord une bobine,
d'inductance L et de résistance interne r connues.
Pour préparer un protocole
d'étude de la bobine de l'injecteur, le technicien choisit d'abord une bobine,
d'inductance L et de résistance interne r connues.
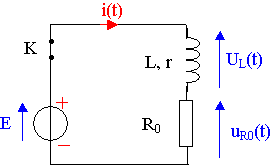
Il réalise ensuite le circuit ci-contre où l'interrupteur est au départ fermé.
On rappelle que la tension aux bornes de la bobine
est : uL(t) = L.di/dt + r.i
Données : E = 6,0 V ; L = 0,94 H ;
R0 =150 W ; r = 20 W.
1) L'interrupteur K étant fermé, et le régime permanent établi, l'intensité dans le circuit est constante et notée I0.
Montrer que I0 = E / (R0 + r).
2) A l'instant t0 = 0, l'interrupteur est ouvert. On a alors la relation uL(t) + uR0(t) = 0.
Établir l'équation différentielle vérifiée par l'intensité i(t).
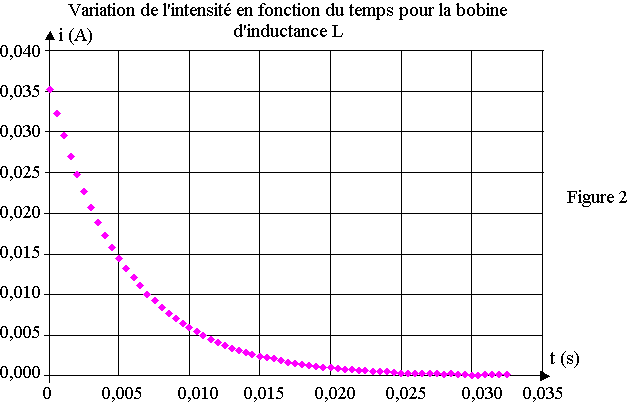
3) Le technicien utilise une interface d'acquisition et un capteur de tension pour suivre l'évolution temporelle de la tension uR0(t), à l'ouverture de l'interrupteur. Un tableur permet alors de calculer le graphe de l'intensité du courant et de tracer le graphe de son évolution temporelle donnée sur la figure 2 de l'annexe.
a) A partir de l'allure de la courbe i(t) de la figure 2, préciser le rôle de la bobine dans ce circuit.
On note t = L / (R0 + r) la constante de temps de ce circuit.
b) Montrer que t a la dimension d'un temps.
c) Calculer t.
d) Mesurer sur le graphique l'intensité i(t) pour t = t.
II ) Mesure des caractéristiques de la bobine de l'injecteur
Le technicien utilise maintenant la bobine de l'injecteur afin de déterminer son inductance L' et sa résistance r' .
Il réalise avec cette bobine le circuit de l'étude précédente (E = 6,0 V; R0= 150 W) et il effectue une nouvelle acquisition comme à la question I-3.
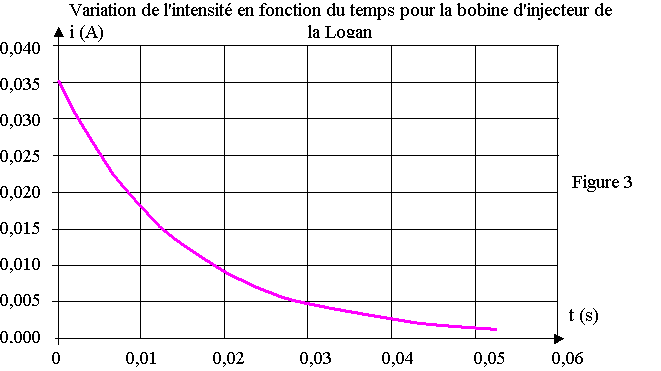
A l'instant t0 = 0, il ouvre l'interrupteur et obtient le tracé donné sur la Figure 3 en annexe à rendre avec la copie.
A l'aide de l'étude précédente et du graphique de la figure 3, déterminer :
1) La résistance interne r ' de la bobine (on rappelle que I'0 = E / (R0 + r ' ).
2) a) Évaluer graphiquement la constante de temps t'.
b) Déterminer l'inductance L' de la bobine.
Annexe à rendre avec la copie
©Sciences Mont Blanc
Liban - Juin 2006 - II ) Teneur en CO2 d'un vin :
Le vin est obtenu par fermentation du jus de raisin.
Lors de la fermentation alcoolique, le glucose présent dans le raisin est dégradé en éthanol et en dioxyde de carbone CO2. Lorsque la vinification est terminée, on décèle généralement dans le vin la présence de CO2 à raison de 200 à 700 mg par litre.
Pour déterminer la concentration en CO2 d’un vin, les laboratoires d’œnologie analysent, par spectrophotométrie, les échantillons que leur fournissent les viticulteurs.
A l’aide d’un spectrophotomètre, l’absorbance de cet échantillon est mesurée pour une gamme de longueurs d’onde données (situées de part et d’autre du maximum d’absorption dû à la présence de CO2). Ces mesures sont ensuite reportées sur un graphe constituant le spectre d’absorption de l’échantillon pour la gamme de longueurs d’onde choisie.
Dans tout cet exercice on considèrera que dans la gamme de longueurs d’onde choisies, seul le CO2 absorbe.
Un élève cherche à déterminer la concentration en CO2 d’un échantillon de vin. Il dispose pour cela de quatre autres échantillons de vin de concentration en CO2 connues :
Échantillon n°1 C1 = 4,5 mmol.L-1
Échantillon n°2 C2 = 10,4 mmol.L-1
Échantillon n°3 C3 = 24,3 mmol.L-1
Échantillon n°4 C4 = 29,5 mmol.L-1
Échantillon n°5 C5 à déterminer
Il réalise le spectre d’absorption de chacun de ces échantillons et obtient le graphe de l’absorbance en fonction de l’inverse de la longueur d’onde (le nombre d’onde 1/l) donné ci-dessous :
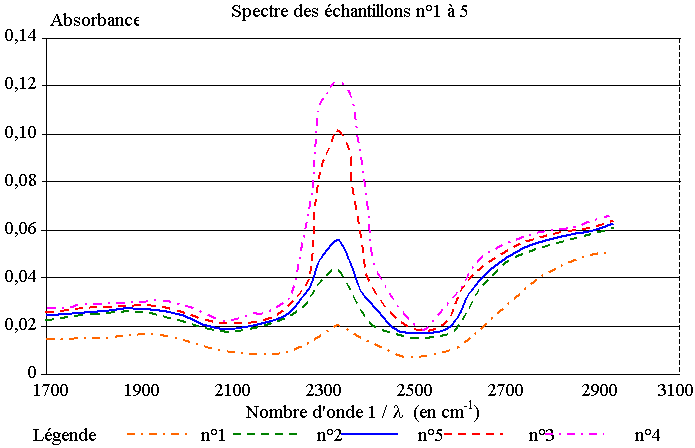
1) On se place, pour chaque échantillon, au maximum d’absorption dû au CO2.
a) Déterminer graphiquement la valeur de l’absorbance pour le maximum d’absorption de chaque échantillon.
b) Tracer la courbe d’étalonnage A = f (C) représentant l’absorbance de la solution en fonction de la concentration en CO2 de l’échantillon.
c) Quelle est l’allure de la courbe tracée à la question 1.b) ? Sans aucun calcul que peut-on en déduire ?
2) La loi de Beer-Lambert, pour des solutions homogènes diluées, a pour expression A = e.L.C, où C est la concentration molaire de l’espèce absorbante, L la largeur de la cuve (pastille) et e le coefficient d’extinction molaire de l’espèce absorbante à la longueur d’onde d’étude.
a) La courbe obtenue à la question 1.b) vous semble-t-elle en accord avec cette loi ?
b) Utiliser cette courbe pour déterminer la valeur du coefficient e, en unités SI, sachant que L = 3,5.10-3 m.
3) a) A l’aide de la courbe, A = f(C), déterminer la concentration en CO2 de l’échantillon inconnu n°5.
Expliciter clairement la démarche suivie.
b) Le vin contenu dans cet échantillon entre-t-il dans la catégorie des vins cités dans le texte (en ce qui concerne sa teneur en CO2) ?
Données : M(C) = 12 g.mol-1 ; M(O) = 16 g.mol-1
©Sciences Mont Blanc
Liban - Juin 2006 - III ) pH d'un mélange:
Dans cet exercice, on se propose de calculer la valeur du pH d’un mélange de deux solutions de pH connus.
Données : pKa1 (HNO2 / NO2–) = 3,3
pKa2 (HCOOH / HCOO–) = 3,8
pKe = 14,0
I ) Étude de deux solutions
Le pH d’une solution aqueuse d’acide nitreux HNO2(aq), de concentration en soluté apporté C1 = 0,20 mol.L-1 a pour valeur
pH1 = 1,3 ; celui d’une solution aqueuse de méthanoate de sodium (HCOO–(aq) + Na+(aq)) de concentration en soluté apporté
C2 = 0,40 mol.L-1 a pour valeur pH2 = 8,7.
1) a) Écrire l’équation de la réaction entre l’acide nitreux et l’eau.
Donner l’expression de sa constante d’équilibre.
b) Écrire l’équation de la réaction entre l’ion méthanoate et l’eau.
Donner l’expression de sa constante d’équilibre.
2) a) Sur l’axe des pH, donné en annexe à rendre avec la copie, placer les domaines de prédominance des deux couples acide/base mis en jeu.
b) Préciser l’espèce prédominante dans chacune des deux solutions précédentes.
II ) Étude d'un mélange de ces solutions
1) On mélange un même volume V = 200 mL de chacune des deux solutions précédentes.
La quantité de matière d’acide nitreux introduite dans le mélange est n1 = 4,0 ´ 10-2 mol et celle de méthanoate de sodium est
n2 = 8,0 ´ 10-2 mol.
a) Écrire l’équation de la réaction qui se produit lors du mélange entre l’acide nitreux et l’ion méthanoate.
b) Exprimer, puis calculer, le quotient de réaction Qr,i associé à cette équation, dans l’état initial du système chimique.
c) Exprimer le quotient de réaction dans l’état d’équilibre Qr,éq en fonction des constantes d’acidité des couples puis le calculer.
d) Conclure sur le sens d’évolution de la réaction écrite en 1.a).
2) a) Compléter le tableau d’avancement, donné en annexe à rendre avec la copie.
b) La valeur de l’avancement final, dans cet état d’équilibre est : xéq = 3,3 ´ 10-2 mol.
Calculer les concentrations des différentes espèces chimiques présentes à l’équilibre.
c) En déduire la valeur de Qr, éq et la comparer à la valeur obtenue à la question 1. c).
3) À l’aide de l’un des couples intervenant dans le mélange, vérifier que la valeur du pH du mélange est proche de la valeur pH3 = 4.
Annexe à rendre avec la copie
Axe des pH

Tableau d'avancement de la transformation entre l'acide nitreux et le méthanoate de sodium
|
Équation |
………….. + …………. = ………… + …………. |
||||
|
État du système chimique |
Avancement (mol) |
Quantités de matière (mol) |
|||
|
n(HNO2(aq)) |
n(HCOO–(aq)) |
…………. |
…………. |
||
|
État initial |
x = 0 |
n1 |
n2 |
||
|
État intermédiaire |
x |
||||
|
État d’équilibre |
x = xéq |
||||
©Sciences Mont Blanc
Liban - Juin 2006 - I ) (spe) :
©Sciences Mont Blanc