Sujet Baccalauréat France - Juin 2007
Calculatrice interdite ![]()
II ) Découvertes liées à des éclipses de Soleil ( 6,5 points)
III ) Synthèse d'un ester ( 4 points)
I ) Synthèse d'un conservateur (4 points) (spe)
Sujet Bac France - Juin 2007 - I ) La galiote :
La galiote était un navire de guerre qui fit son apparition à la fin du XVIIème siècle, sous le règne de Louis XIV. Les galiotes possédaient de lourds canons, fixés au pont, projetant des boulets de 200 livres (environ 100 kg) portant jusquà 1200 toises (environ 2400 m).
Selon la description détaillée de Renau, Inspecteur Général de la Marine, ces bâtiments sont destinés à emporter des canons en mer. Ils sont de moyenne grandeur et à fond plat. De par leur fabrication, langle de tir des canons est fixe et a pour valeur α = 45°, ce qui permet de tirer à la plus grande distance possible.
La structure dune galiote doit être très robuste pour résister à la réaction considérable du boulet et leur échantillon(1) est ordinairement aussi fort que celui dun vaisseau de 50 canons.
(1) dimension et épaisseur des pièces utilisées pour la construction.
Daprès le site Internet de lInstitut de Stratégie Comparée.
Les parties 1, 2 et 3 de cet exercice sont indépendantes.
Certaines aides au calcul peuvent comporter des résultats ne correspondant pas au calcul à effectuer.
1) Action de la poudre de canon sur le boulet
Léjection du boulet est provoquée par la combustion de la poudre. Une force de poussée est donc exercée sur le boulet par lensemble {galiote + canon + gaz}.
Justifier lexpression soulignée dans le texte encadré ci-dessus, à laide dune des trois lois de Newton. Énoncer cette loi. (On pourra saider dun schéma).
2) La trajectoire du boulet
On souhaite étudier la trajectoire du centre dinertie G du boulet de masse m. Létude est faite dans le référentiel terrestre considéré comme galiléen.
Le repère détude est (O,  ,
,  )
et lorigine des dates est choisie à linstant où le boulet part du point
O (voir figure 1 ci-dessous).
)
et lorigine des dates est choisie à linstant où le boulet part du point
O (voir figure 1 ci-dessous).
Le vecteur vitesse initiale![]() G
du point G est incliné dun angle α
(appelé angle de tir) par rapport à lhorizontale.
G
du point G est incliné dun angle α
(appelé angle de tir) par rapport à lhorizontale.
Une fois le boulet lancé, la force de poussée de la partie précédente nintervient plus.

Données :
Volume du boulet : V = 16 dm 3 = 16 L
Masse du boulet : m = 100 kg
Valeur du champ de pesanteur : g = 10 m.s 2
Masse volumique de lair : ρ = 1,3 kg.m 3
|
Aide au calcul |
|||
|
1,6 x 1,3 = 2,1 |
|
||
|
1,6 / 1,3 = 1,2 |
1,3 / 1,6 = 0,81 |
|
|
2.1) Inventaire des forces agissant sur le boulet après son lancement
2.1.1) La poussée dArchimède
Donner lexpression littérale de la valeur FA de la poussée dArchimède puis la calculer.
2.1.2) Le poids
Calculer la valeur P du poids du boulet après avoir précisé son expression littérale.
2.1.3) Dans cet exercice, on pourra négliger la poussée dArchimède devant le poids si la valeur de ce dernier est au moins cent fois plus grande que celle de la poussée dArchimède. Montrer que lon est dans cette situation.
2.1.4) Pendant le vol, compte tenu de la masse, de la vitesse et de la forme du boulet, on fait lhypothèse que les forces de frottement dans lair sont négligeables devant le poids. En tenant compte de la remarque et des résultats précédents, établir le bilan des forces exercées sur le système {boulet} pendant le vol.
2.2) Equation de la trajectoire
Dans toute cette partie, on négligera la poussée dArchimède et on ne tiendra pas compte des forces de frottement dues à lair.
2.2.1) En appliquant la deuxième loi de Newton, montrer que les équations horaires du mouvement du point G sécrivent :
x(t) = (v0 .cos α) . t et y(t) = - ½ g . t2 + (v0 . sin α) . t
2.2.2) Montrer que léquation de la trajectoire peut se mettre sous la forme y(x) = Ax2 + Bx.
On donnera les expressions littérales de A et B et on précisera leurs unités respectives.
2.3) Portée du tir
Léquation de la trajectoire du boulet peut se mettre sous la forme y(x) = x × (Ax + B).
Au cours dun tir dentraînement, un boulet tombe dans leau.
Dans ces conditions, la distance entre le point de départ du boulet et son point M dimpact sur leau est appelée portée (voir figure 1 page 2).
On négligera la différence daltitude entre les points O et M devant les autres distances.
2.3.1) Exprimer la portée d du tir en fonction de A et B.
2.3.2) Lexpression littérale de la portée d en fonction de v0 , α et g est : d = v02 . sin 2 α / g
Retrouver, en la justifiant, la valeur α = 45° donnée dans le texte, pour laquelle la portée est maximale, pour une vitesse v0 donnée.
2.3.3) A partir de la question précédente et des données, calculer la vitesse initiale du boulet pour atteindre la portée maximale donnée dans le texte.
2.3.4) En fait, les frottements dans lair ne sont pas négligeables.
Avec un angle de tir restant égal à 45°, la vitesse initiale du boulet doit-elle être supérieure ou inférieure à celle trouvée à la question 2.3.3. pour obtenir la même portée maximale ? Justifier sans calcul.
3) Restauration dun boulet par électrolyse
Un boulet est retrouvé par un archéologue, qui le restaure par électrolyse en solution basique.
Ce procédé a pour but, notamment :
- déliminer la gangue (substance qui forme une enveloppe autour d'une autre matière) qui entoure le boulet ;
- de débarrasser lobjet de tous les ions chlorure qui, au contact de lhumidité de lair et du dioxygène amènent à la formation dacide chlorhydrique conduisant à la destruction rapide du boulet. Ces ions chlorure sont également présents dans la gangue.
Le schéma de principe de lélectrolyse est le suivant :

La lente destruction de la gangue libère dans lélectrolyte les ions chlorure quelle contenait.
Léquation de la réaction modélisant lélectrolyse est :
2 Cl- (aq) + 2 H2O (l) = Cl2 (g) + H2 (g) + 2 HO- (aq)
Les couples doxydoréduction mis en jeu sont : Cl2 (g) / Cl- (aq) et H2O (l) / H2 (g)
3.1) La réaction se produisant à lanode est-elle une oxydation ou une réduction ?
3.2) Ecrire léquation de la réaction ayant lieu à lanode.
A quelle borne du générateur est reliée cette électrode ?
3.3) A lune des électrodes, on observe un dégagement de dihydrogène.
Léquation de la réaction électrochimique associée est :
2 H2O (l) + 2 e- = H2 (g) + 2 HO- (aq) (1)
La pression exercée par le dihydrogène permet de décoller la gangue. Lélimination de la gangue se fait sous une intensité I constante et pendant une durée Δt qui dépendent, entre autres, de la nature de lobjet et de son état de corrosion.
Données :
Charge élémentaire : e = 1,6 x 10 19 C Constante dAvogadro : NA = 6,0 x 10 23 mol 1
Intensité du courant : I = 1,0 A Durée de lélectrolyse : Δt = 530 heures
|
Aide au calcul |
|||
|
5,3 x 3,6 ≈ 19 |
2 x 1,6 x 6 ≈ 19 |
5,3 / 3,6 = 1,5 |
2 x 6 / 1,6 = 7,5 |
On note Q la valeur absolue de la charge électrique totale ayant circulé dans le dispositif pendant la durée Δt de lélectrolyse.
3.3.1) Donner lexpression littérale du nombre N délectrons transférés et celle de la quantité délectrons n(e) en fonction des grandeurs données.
3.3.2) Pour simplifier, on fait lhypothèse que la réaction correspondant à léquation (1) est la seule à se produire au niveau de lélectrode concernée.
En saidant éventuellement dun tableau davancement, établir une relation entre la quantité n(H2) de dihydrogène dégagé et la quantité délectrons n(e) et en déduire que n(H2) = ½ I . Δt / (e . NA)
3.3.3) Calculer la valeur de n(H2).
3.3.4) En déduire quel serait le volume de dihydrogène dégagé dans les conditions de lexpérience.
On donne le volume molaire des gaz dans les conditions de lexpérience : VM = 24 L. mol 1 .
©Sciences Mont Blanc
Sujet Bac France - Juin 2007 - II ) Découvertes liées à des éclipses de Soleil:
Cet exercice se compose de deux parties indépendantes.
Certaines aides au calcul peuvent comporter des résultats ne correspondant pas au calcul à effectuer.
A) Partition lunaire
Des chercheurs du CEA de léquipe dElisabeth Blanc viennent dannoncer quune éclipse na pas pour seul effet une baisse de la luminosité. Lors de léclipse du Soleil du 11 août 1999, à 12 h 16 précises, lombre de la Lune commence sa traversée de la France à la vitesse de 2850 km.h 1 sur un axe Cherbourg-Strasbourg.
Sur son passage, la température de lair chute rapidement denviron 5 °C. Le déplacement de cette zone froide, à la même vitesse que celui de lombre ( ), engendre dans son sillage des ondes transversales dont la fréquence est largement inférieure à 20 Hz.
Daprès la revue Les Défis du CEA - n° 97 octobre-novembre 2003
1) Ondes créées lors de léclipse
1.1) Définir une onde mécanique progressive.
1.2) Définir une onde transversale.
1.3) Dire, en justifiant la réponse, si les ondes créées lors de léclipse peuvent être sonores.
2) Caractéristiques des ondes créées
Léquipe en charge du projet a pu détecter à faible altitude, une série dondes dont la période moyenne est de lordre de 10 minutes et la célérité moyenne est de lordre de 100 km.h 1.
2.1) Vérifier que la fréquence de londe est effectivement largement inférieure à 20 Hz.
2.2) Ces ondes peuvent-elles être diffractées par des montagnes séparées par une distance de 10 km ? Justifier la réponse.
|
Aide au calcul |
|
|
1 / 6 = 1,7.10-1 |
1 / 36 = 2,8.10-2 |
B) Découverte historique dun nouvel élément chimique
Lors de léclipse totale du Soleil du 18 août 1868, le français Pierre Janssen et le britannique Norman Lockyer ont analysé le spectre de la couronne solaire et ont remarqué quil présentait une raie brillante dans le jaune très proche de celle du sodium. N. Lockyer a émis lhypothèse que cette raie était due à un nouvel élément quil baptisa hélium (du grec hélios qui signifie Soleil).
Ce nest que vingt-sept ans plus tard que cet élément chimique fut identifié sur Terre.
Données :
Célérité de la lumière dans le vide : c = 2,998 x 108 m.s 1
Constante de Planck : h = 6,626 x 10 34 J.s
1 eV = 1,602 x 10 19 J
Longueur donde de la raie D du sodium dans le vide : λNa = 589,0 nm.
Longueur donde de la raie jaune de lhélium dans le vide : λHe = 587,6 nm.
|
Aide au calcul |
|
|
6,626 x 2,998 x 1,602 / 589,0 = 5,403 x 10-2 |
6,626 x 2,998 / (587,6 x 1,602 ) = 2,110 x 10-2 |
|
6,626 x 2,998 / (589,0 x 1,602 ) = 2,105 x 10-2 |
6,626 x 2,998 x 1,602 / 587,6 = 5,416 x 10-2 |
1) Spectre dénergie
1.1) Illustrer, en saidant dun schéma de niveaux dénergie dun atome, le phénomène démission dun photon (quantum dénergie lumineuse).
1.2) On note E lénergie du photon émis lors dune transition énergétique dun atome.
Donner lexpression littérale de E en fonction de la longueur donde λ de la radiation lumineuse émise dans le vide, de la constante de Planck h et de la célérité de la lumière dans le vide c.
1.3) Raie D du sodium
1.3.1) Calculer la valeur de E en électronvolts, pour le rayonnement correspondant à la raie D du sodium.
1.3.2) Déterminer, en saidant de la figure 2 page 7, à quelle transition correspond cette émission.
1.4) Lénergie du photon correspondant à lémission de la raie jaune de lhélium (de longueur donde λHe) est égale à 2,110 eV.
En saidant de la figure 2 page 7, justifier que cette émission ne peut pas être attribuée au sodium.
2) Formation de lhélium dans le Soleil
Les noyaux dhélium 3 et dhélium 4 peuvent être produits par une suite de réactions nucléaires dont les équations sont indiquées ci-dessous :
11H + 11H → 21H + 01e
11H + 21H → 32He
32He + x2He → 42He + y 11H
2.1) Quel nom donne-t-on à ces réactions nucléaires ?
2.2) Parmi les noyaux 32He , 31H et 42He , lesquels sont isotopes ? Justifier.
2.3) Déterminer les valeurs de x et y dans la troisième équation de réaction et justifier la réponse en précisant les lois de conservation utilisées.
2.4) On étudie dans la couronne solaire les spectres démission des atomes dhélium 3 et
dhélium 4. On rappelle quun spectre atomique caractérise la configuration électronique de latome (cest-à-dire le nuage délectrons de latome).
2.4.1) Ces deux types datomes possèdent-ils la même configuration électronique ? Justifier.
2.4.2) Ces deux atomes auraient-ils pu être distingués lun de lautre expérimentalement dans le spectre obtenu par Pierre Janssen et Norman Lockyer ?

©Sciences Mont Blanc
Sujet Bac France - Juin 2007 - III ) Synthèse d'un ester :
L'huile essentielle de Gaulthérie autrement appelée "essence de Wintergreen" est issue d'un arbuste d'Amérique septentrionale : le palommier, également appelé "thé du Canada", "thé rouge", "thé de Terre Neuve". Cette substance est un anti-inflammatoire remarquable. Elle est aussi utilisée en parfumerie et comme arôme dans lalimentation. Autrefois, elle était obtenue par distillation complète de la plante.
Cette huile est constituée principalement de salicylate de méthyle. Il est possible de synthétiser cet ester au laboratoire, à partir de lacide salicylique et du méthanol selon la réaction déquation :
C7H6O3(s) + CH4O (l) = C8H8O3 (l) + H2O (l)
Cet exercice comporte 13 AFFIRMATIONS concernant un mode opératoire de cette synthèse.
Laide au calcul peut comporter des résultats ne correspondant pas au calcul à effectuer.
Toute réponse doit être accompagnée de justifications ou de commentaires. A chaque affirmation, répondre par VRAI ou FAUX, en justifiant le choix à laide de définitions, de schémas, de calculs, déquations de réactions,
SI LAFFIRMATION EST FAUSSE, DONNER LA RÉPONSE JUSTE.
Données :
|
Nom |
Formule |
Masse molaire en g.mol 1 |
Masse volumique en g.mL 1 |
Température débullition en °C (pression 1 bar) |
|
Acide salicylique |
C7H6O3 |
M1 = 138 |
&teta;1 = 211 |
|
|
Méthanol |
CH4O |
M2 = 32 |
ρ2 = 0,8 |
&teta;2 = 65 |
|
Salicylate de méthyle |
C8H8O3 |
M3 = 152 |
ρ3 = 1,17 |
&teta;3 = 223 |
|
Cyclohexane |
C6H12 |
M4 = 84 |
ρ4 = 0,78 |
&teta;4 = 81 |
Formule de lion hydrogénocarbonate : HCO3-
Masse volumique de leau : 1,0 g.mL 1
Couples acide/base : HCO3-(aq) / CO32- (aq)
CO2 , H2O / HCO3-(aq); le dioxyde de carbone est un gaz peu soluble dans leau
|
Aide au calcul |
||
|
1,38 / 2,76 = 0,500 |
2,76 / 1,38 = 2,00 |
2,1 / 7,6 = 0,28 |
|
2,1 / 3,04 = 0,69 |
1,52 / 2,1 = 0,72 |
2,1 / 1,52 = 1,4 |
Dans un ballon, on introduit une masse m1 = 27,6 g dacide salicylique, un volume V2 denviron 20 mL de méthanol et 1 mL dacide sulfurique concentré.
Puis on chauffe à reflux. Sur le flacon de méthanol, on peut
voir les pictogrammes suivants :
|
|
R : 11 - Facilement inflammable. R : 23/25 - Toxique par inhalation et par ingestion. S : 7 - Conserver le récipient bien fermé. S : 16 - Conserver à l'écart de toute flamme ou source d'étincelles - Ne pas fumer. S : 24 - Eviter le contact avec la peau. S : 45 - En cas d'accident ou de malaise consulter immédiatement un médecin. |
|
|
AFFIRMATION 1 : on doit manipuler le méthanol sous la hotte.
AFFIRMATION 2 : le schéma dun chauffage à reflux est le suivant :
 AFFIRMATION 3 : pour prélever
le méthanol, il faut absolument utiliser une pipette jaugée munie dune poire
à pipeter (ou propipette).
AFFIRMATION 3 : pour prélever
le méthanol, il faut absolument utiliser une pipette jaugée munie dune poire
à pipeter (ou propipette).
AFFIRMATION 4 : la quantité n1 dacide salicylique introduit vaut n1 = 2,00 x 10 1 mol.
AFFIRMATION 5 : la quantité n2 de méthanol introduit vaut environ n2 = 5 mol.
AFFIRMATION 6 : léquation associée à la réaction de synthèse
du salicylate de méthyle sécrit :
 Acide salicylique |
AFFIRMATION 7 : le réactif introduit en excès est le méthanol.
Après plusieurs heures de chauffage, on refroidit à température ambiante. On ajoute 100 mL deau glacée et on verse dans une ampoule à décanter. On extrait la phase organique avec du cyclohexane. Cette phase a une masse volumique proche de celle du cyclohexane.
AFFIRMATION 8 : la phase organique se situe dans la partie
inférieure de lampoule à décanter. ![]()
La phase organique contient lester, du méthanol, du cyclohexane et des acides. On lave ensuite plusieurs fois cette phase avec une solution aqueuse dhydrogénocarbonate de sodium afin déliminer les acides restant dans la solution. Il se produit un dégagement gazeux.
AFFIRMATION 9 : le gaz est du dioxyde de carbone.
On effectue à nouveau un lavage à leau et on sèche. On sépare les constituants de la phase organique par distillation.
AFFIRMATION 10 : lors de la distillation, le salicylate de méthyle est recueilli en premier.
Après purification, on récupère une masse m3 = 21 g de salicylate de méthyle.
AFFIRMATION 11 : le rendement de cette synthèse est de 50 %.
AFFIRMATION 12 : lajout dacide sulfurique a permis daugmenter le rendement de la synthèse.
AFFIRMATION 13 : lexcès dun des réactifs a permis daugmenter le rendement de la synthèse.
©Sciences Mont Blanc
Sujet Bac France - Juin 2007 - I ) Synthèse d'un conservateur (spe)
Lacide benzoïque est un conservateur présent dans de nombreuses boissons sans alcool.
Son code européen est E 210. Il peut être préparé par synthèse en laboratoire.
Principe de cette synthèse : l'oxydation, en milieu basique et à chaud de l'alcool benzylique C6H5CH2OH par les ions permanganate MnO4- en excès, conduit à la formation d'ions benzoate C6H5CO2 et de dioxyde de manganèse MnO2 (solide brun). Cette transformation est totale.
Après réduction, par l'éthanol, des ions permanganate MnO4 excédentaires et élimination du dioxyde de manganèse MnO2, on obtient une solution incolore contenant les ions benzoate.
L'addition d'acide chlorhydrique à cette solution permet la cristallisation de l'acide benzoïque C6H5CO2H (solide blanc), que l'on recueille après filtration, lavage et séchage.
Certaines aides au calcul comportent des résultats ne correspondant pas au calcul à effectuer.
1) Questions relatives au protocole expérimental
1.1) Donner, sans justifier, le nom des parties manquantes (verrerie, nom de montage ), notées de Œ à Ž dans le texte de lencadré ci-dessous décrivant le protocole expérimental.
1) Formation de lacide benzoïque :
 Après avoir versé dans un
ballon bicol posé sur un valet et sous la hotte un volume V1
= 2,0 mL d'alcool benzylique puis bouché lensemble, on ajoute environ 20
mL de soude de concentration 2 mol.L1 à laide d Œ.
On introduit ensuite quelques grains de pierre ponce dans le ballon pour
réguler lébullition lors du chauffage.
Après avoir versé dans un
ballon bicol posé sur un valet et sous la hotte un volume V1
= 2,0 mL d'alcool benzylique puis bouché lensemble, on ajoute environ 20
mL de soude de concentration 2 mol.L1 à laide d Œ.
On introduit ensuite quelques grains de pierre ponce dans le ballon pour
réguler lébullition lors du chauffage.
On réalise alors , permettant de chauffer le mélange sans perte de matière ni surpression.
Après avoir versé lentement une solution aqueuse de permanganate de potassium dans le ballon, on porte le mélange à ébullition douce pendant 10 minutes environ. On ajoute quelques millilitres d'éthanol afin d'éliminer le réactif en excès, puis on refroidit le ballon et son mélange.
2) Cristallisation de lacide benzoïque :
On filtre le mélange obtenu, rapidement, en utilisant Ž et on recueille un filtrat limpide et incolore. Le filtrat est ensuite versé dans un becher et refroidi dans la glace.
On ajoute prudemment 8,0 mL d'acide chlorhydrique concentré goutte à goutte et on observe la formation du précipité blanc d'acide benzoïque. On filtre et on rince avec un peu d'eau bien froide.
On récupère les cristaux d'acide benzoïque sur une coupelle préalablement pesée dont la masse est m = 140,4 g.
On les sèche dans une étuve, puis on pèse lensemble et on trouve une masse m = 141,8 g.
1.2) Nommer sur la copie les éléments du montage de la figure 3 ci-dessus repérés par les lettres A, B et C.
1.3) Afin de caractériser le produit formé, on réalise une chromatographie sur couche mince.
Dans trois tubes à essais, on verse 1 mL déluant E ; dans le tube 1 on ajoute une goutte dalcool benzylique, dans le tube 2 une pointe de spatule du solide obtenu et dans le tube 3 une pointe de spatule dacide benzoïque pur.
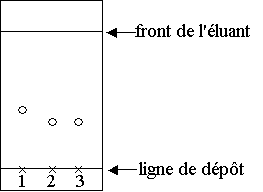 On réalise une chromatographie sur couche
mince à partir du contenu des trois tubes et léluant E puis on révèle le
chromatogramme sous rayonnement UV.
On réalise une chromatographie sur couche
mince à partir du contenu des trois tubes et léluant E puis on révèle le
chromatogramme sous rayonnement UV.
Interpréter le chromatogramme réalisé lors de la synthèse et conclure quant à la nature du solide obtenu.
2) Rendement de la synthèse
Répondre, dans cette seconde partie, en choisissant la bonne réponse. Justifier clairement ce choix (définition, expression littérale et application numérique, tableau davancement ).
Une réponse non justifiée ne sera pas prise en compte.
Données :
|
Nom |
Alcool benzylique |
Permanganate de potassium |
Acide benzoïque |
|
Formule |
C6H5CH2OH |
KMnO4 |
C6H5CO2H |
|
Masse molaire en g.mol 1 |
M1 = 108 |
M2 = 158 |
M3 = 122 |
|
Masse volumique en g.mL 1 |
ρ1 = 1,0 |
ρ3 = 1,3 |
2.1) Loxydation se fait en milieu basique. Léquation chimique de la réaction doxydoréduction qui se produit entre lalcool benzylique et les ions permanganate sécrit :
3 C6H5CH2OH (l) + 4 MnO4- (aq) = 3 C6H5CO2-(aq) + 4 H2O (l) + 4 MnO2 (s) + HO- (aq)
Les couples oxydant / réducteur mis en jeu lors de la synthèse de lacide benzoïque sont les suivants : C6H5CO2-(aq) / C6H5CH2OH (l) et MnO4- (aq) / MnO2 (s).
Choisir les deux demi-équations électroniques associées à la transformation décrite ci-dessus.
|
a) C6H5CO2-(aq) + 4 e + 4 H2O (l) |
= |
C6H5CH2OH (l) + 5 HO- (aq) |
|
b) C6H5CO2-(aq) + 4 e + 5 H+ (aq) |
= |
C6H5CH2OH (l) + H2O (l) |
|
c) MnO4- (aq) + 8 H+ (aq) + 5 e |
= |
Mn2+(aq) + 4 H2O (l) |
|
d) MnO4- (aq) + 3 e + 2 H2O (l) |
= |
MnO2 (s) + 4 HO- (aq) |
|
e) MnO4- (aq) + 3 e + 4 H+ (aq) |
= |
MnO2 (s) + 2 H2O (l) |
2.2) La quantité n1 dalcool benzylique contenue dans la prise dessai de 2,0 mL vaut :
a) n1 = 1,9 x 10 -2 mol ;
b) n1 = 5,4 x 10 - 2 mol ;
c) n1 = 1,9 x 10 - 5 mol.
|
Aide au calcul |
||
|
2,0 / 108 = 1,9 x 10-2 |
108 / 2,0 = 54 |
2,0 x 10-3 = 1,9 x 10-5 |
Pour toute la suite, on précise que la quantité dions permanganate apportée vaut n2 = 3,0.10-2 mol.
2.3) Lors de loxydation de lalcool benzylique, les ions permanganate doivent être introduits en excès.
Choisir la bonne proposition (on pourra saider dun tableau dévolution du système).
a) Les ions permanganate ont été introduits en excès.
b) Les ions permanganate nont pas été introduits en excès.
|
Aide au calcul |
|
|
1,9 / 3 = 0,63 |
1,9 x 3 = 5,7 |
2.4). Lors de la cristallisation, le passage des ions benzoate à lacide benzoïque se fait selon léquation chimique :
C6H5CO2-(aq) + H3O+ = C6H5CO2H (s) + H2O (l)
La masse théorique maximale mmax dacide benzoïque quil aurait été possible dobtenir vaut :
a) mmax = 1,6.10 2 g ;
b) mmax = 6,6 g ;
c) mmax = 2,3 g.
|
Aide au calcul |
||
|
1,9 / 122 = 1,6 x 10-2 |
5,4 x 122 = 6,6x 102 |
1,9 x 122 = 2,3 x 102 |
2.5) Le rendement r de la synthèse effectuée vaut :
a) r = 21 % ;
b) r = 61 % ;
c) r = 88 %.
|
Aide au calcul |
||
|
1,4 / 6,6 = 0,21 |
1,4 x 2,3 = 0,61 |
1,4 / 1,6 = 0,88 |
©Sciences Mont Blanc
 2,4 ≈ 1,5
2,4 ≈ 1,5




