Sujet Bac Nouvelle Calédonie Novembre 2004
Calculatrice autorisée
II ) Etat final d'un système chimique : étude par spectrophotométrie (6,5 points)
III ) (4 points)
I ) (spe) (4 points)
I ) :
©Sciences Mont Blanc
II ) Etat final d'un système chimique : étude
par spectrophotométrie :
Les ions iodure (I-) réagissent avec les ions peroxodisulfate (S2O82-).
L’équation associée à la réaction s’écrit : 2 I-(aq) + S2O82-(aq) = I2(aq) + 2 SO42-(aq) (1)
En présence d’ions iodure, le diiode se transforme en ions triiodure (I3-) de couleur brune.
Pour simplifier l’écriture, on raisonnera à partir de l’équation (1) sans tenir compte de la formation des ions triiodure.
A un instant pris pour origine des dates (t = 0 min), on réalise un mélange réactionnel S à partir d’un volume V1 = 10,0 mL de solution aqueuse d’iodure de potassium (K+(aq) + I-(aq)) de concentration molaire en soluté apporté c1 = 5,0.10-1 mol.L-1 et d’un volume V2 = 10,0 mL de solution aqueuse de peroxodisulfate de sodium ( 2 Na+(aq) + S2O82-(aq)) de concentration molaire en soluté apporté c2 = 5,0.10-3 mol.L-1.
I ) Suivi spectrophotométrique de la transformation chimique.
On souhaite étudier la formation du diiode au cours du temps par spectrophotométrie.
Un prélèvement du mélange réactionnel S est introduit rapidement dans la cuve d’un spectrophotomètre dont la longueur d’onde est réglée sur une valeur adaptée à l’absorption par le diiode. On admettra que le diiode est la seule espèce colorée présente dans le mélange et qu’au cours de l’expérience la température de la solution reste constante.
Les résultats des mesures d’absorbance en fonction du temps sont rassemblées dans le tableau ci-dessous :
|
t(min) |
1 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
30 |
40 |
50 |
60 |
90 |
|
A |
0,08 |
0,13 |
0,23 |
0,31 |
0,39 |
0,45 |
0,50 |
0,55 |
0,59 |
0,62 |
0,65 |
0,74 |
0,77 |
0,79 |
0,79 |
0,79 |
1) La spectrophotométrie est une méthode non destructive
pour suivre l’évolution d’un système chimique. Proposer une autre méthode
de suivi cinétique non destructive.
2) La mesure de l’absorbance A de solutions aqueuses de diiode de différentes concentrations molaires c montre que A est proportionnelle à c. On détermine le coefficient de proportionnalité k à partir du couple de valeurs (c = 5,0.10-3 mol.L-1 ; A = 1,70).
a) Montrer que la valeur du coefficient de proportionnalité k vaut 3,4.102 et préciser son unité.
b) Montrer, que pour que le mélange réactionnel S réalisé au début de l’étude, la quantité de matière de diiode formé à l’instant t s’exprime sous la forme : n(I2)(t) = A(t).(V1+V2) / k
c) Calculer la quantité de matière de diiode formé à l’instant de date t = 90 min.
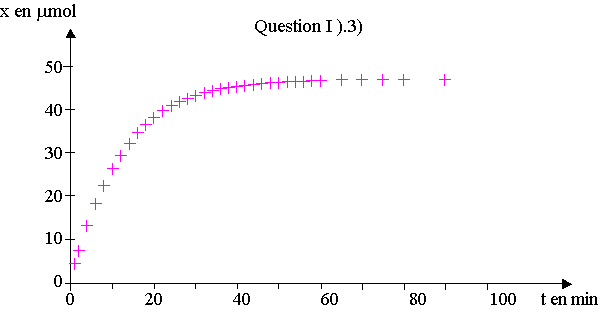
3) On note x l’avancement de la réaction à l’instant de date t.
A cet instant, la quantité de diiode formé est égale à x.
En utilisant les valeurs expérimentales et la relation donnée à la question I ) 2) c) , on obtient la courbe traduisant l’évolution de x en fonction du temps ; cette courbe est représentée sur l’annexe (à rendre avec la copie).
La vitesse volumique de réaction est définie par v = (1/VS).dx/dt où VS correspond au volume de la solution.
a) En précisant la méthode utilisée, décrire l’évolution de cette vitesse au cours du temps.
b) La justifier d’après les connaissances du cours.
c) Donner une méthode qui permettrait d’obtenir plus rapidement la même quantité finale de diiode à partir du même mélange réactionnel S.
II ) titrage du diiode formé après 90 minutes de réaction.
On veut vérifier par un titrage la quantité de matière de diiode formé à l’instant de date
t = 90 min. Pour cela, à cet instant, on introduit dans un erlenmeyer contenant de l’eau glacée un échantillon de volume V = 5,0 mL du mélange réactionnel S. A l’aide d’une solution étalon de thiosulfate de sodium ( 2 Na+(aq) + S2O32-(aq)) de concentration molaire en soluté apporté
c’ = 2,5.10-3 mol.L-1, on titre le diiode présent dans l’échantillon en présence d’un indicateur de fin de réaction. L’équivalence est atteinte pour un volume V’E = 9,2 mL.
L’équation associée à la réaction support du titrage est :
I2(aq) + 2 S2O32-(aq)
= 2 I-(aq)
+ S4O62-(aq)
1) Représenter sur la copie le schéma du dispositif de titrage en précisant le nom du matériel et la nature des solutions.
2) Définir l’équivalence du titrage.
3) Exploitation du titrage.
a) En exploitant le résultat du titrage, exprimer littéralement en fonction de c’ et de V’E la quantité de diiode formé, à l’instant de date t = 90 min, dans le mélange réactionnel décrit au début de l’exercice.
Le candidat s’il le souhaite, pourra compléter et exploiter le tableau d’avancement figurant sur l'annexe (à rendre avec la copie).
b) Calculer la valeur de cette quantité de diiode formé.
c) Cette valeur est-elle compatible avec celle trouvée au I ) 2) c) ?
Aucun calcul d’écart relatif n’est demandé.
III ) Etude théorique et bilan comparatif.
1) L’équation (1) associée à la réaction entre les ions iodure et les ions peroxodisulfate est rappelée ci-dessous :
2 I-(aq) + S2O82-(aq) = I2(aq) + 2 SO42-(aq) (1)
Les couples mis en jeu sont I2(aq) / I-(aq) et S2O82-(aq) / SO42-(aq)
A partir des demi-équations retrouver l’équation (1) associée à la réaction.
2) La transformation chimique est supposée totale.
a) En utilisant les données concernant le mélange réactionnel S, à l’instant t = 0 s, défini en introduction de l’exercice, compléter le tableau d’avancement figurant sur l’annexe (à rendre avec la copie).
b) En déduire l’avancement maximal de la réaction et la quantité de matière maximale en diiode formé.
3) On appelle écart relatif d’une valeur expérimentale nexp(I2)
par rapport à la valeur théorique attendue nth(I2) le
rapport :
½nexp(I2)
– nth(I2)½/ nth(I2)
Comparer les résultats expérimentaux (questions I ) 2) c)
et II ) 3) b) au résultat théorique de la question III ) 2) b) Commenter.
Annexe ( à rendre
avec la copie )
Question II ) 3)
Rappel: le candidat pourra, s'il le souhaite compléter et exploiter le tableau donné ci-dessous :
|
Relation stœchiométrique |
I2(aq) + 2S2O32–(aq) = 2 I–(aq) + S4O62–(aq) |
||||
|
Etat du système |
Avancement |
Quantité de matière en mol |
|||
|
Etat initial |
|||||
|
Au cours de la transformation |
|||||
|
A l'équivalence |
|||||
Question III ) 2)
|
Relation stœchiométrique |
2 I-(aq) + S2O82–(aq) = I2 (aq) + 2 SO42–(aq) |
||||
|
Etat du système |
Avancement |
Quantité de matière en mol |
|||
|
Etat initial |
|||||
|
Au cours de la transformation |
|||||
|
Etat final attendu |
xmax |
||||
©Sciences Mont Blanc
III ) :
©Sciences Mont Blanc
©Sciences Mont Blanc
