Chap 10 – Evolution spontanée d'un système chimique ![]()
I ) Quotient de réaction : (Revoir le cours correspondant et quelques exercices)
équation : aA(aq) + bB(aq) = cC(aq) + dD(aq) Qr = ………./ (……….)
Seules sont représentées les espèces dissoutes en solution, ce qui exclut les solides, les précipités, les gaz non dissous et le solvant souvent l'eau . Qr est sans unité.
A l'équilibre, Qr éq = …. (constante d'équilibre).
II ) Critère d'évolution spontanée :
Une évolution est spontanée si elle se produit sans intervention extérieure.
Au cours du temps, la valeur du quotient de réaction Qr tend vers la constante d'équilibre K .
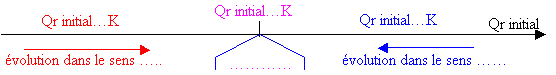
Les trois situations qui peuvent être envisagées : Qrinitial < K , Qrinitial > K ou Qrinitial = K :
1) Qrinitial = K
Le système chimique est à l'………. La réaction se fait dans
les 2 sens mais le mélange n'évolue pas. Les concentrations des espèces chimiques
…………….., Qr reste ………..
2) Qrinitial < K
a A (aq) + b B (aq) = c C (aq) + d D (aq) Qrinitial = [C]c0.[D]d0 / ( [A]a0.[B]b0 )
Si Qr initial < K, cela signifie que le système va évoluer de façon à ce que Qr ……… pour tendre vers … . Il faut donc …….. des espèces C et D, et ………… A et B, le système va donc évoluer dans le sens ……. de l'équation de la réaction .
Cette évolution s'arrêtera lorsque la quotient de la réaction
atteindra la valeur de la constante d'équilibre ….
3) Qrinitial > K :
Si Qr initial > K, cela signifie que le système va évoluer de façon à ce que Qr ………. pour tendre vers … . Il faut donc …… des espèces A et B, et …………. C et D, le système va donc évoluer dans le sens ………… de l'équation de la réaction .
Cette évolution s'arrêtera lorsque la quotient de la réaction atteindra la valeur de la constante d'équilibre ….
4) Diagramme de critère d'évolution :
III ) Application du critère d'évolution spontanée :
1) Réaction acido-basique :
Exercice : On mélange les solutions suivantes :
➢ V1 = 5,0 mL d'une solution d'acide méthanoïque de concentration C1 = 3,0.10 - 2 mol.L-1
➢ V2 = 10,0 mL d'une solution de chlorure d'ammonium de concentration C2 = 4,0.10 - 2 mol.L-1
➢ V3 = 5,0 mL d'une solution de méthanoate de sodium de concentration C3 = 6,0.10 - 2 mol.L-1
➢ V4 = 10,0 mL d'une solution d'ammoniaque de concentration C4 = 8,0.10 - 2 mol.L-1
a) Calculer le quotient de réaction initial en considérant l'acide méthanoïque comme un réactif.
b) Préciser le sens d'évolution spontanée de ce système chimique.
Données: couple HCOOH / HCOO - : pKA1 = 3,8 et couple NH4+/NH3 : pKA2 = 9,2
Solution
2) Réaction d'oxydo-réduction :
Exercice : On mélange les espèces suivantes :
➢ V1 = 20 mL d'une solution de chlorure de fer ( III ) de concentration C1 = 0,030 mol.L-1
➢ V2 = 20 mL d'une solution de sulfate de fer ( II ) de concentration C2 = 0,020 mol.L-1
➢ V3 = 10 mL d'une solution de sulfate de cuivre ( II ) de concentration C3 = 0,10 mol.L-1
➢ 10 g de poudre de cuivre.
Données : couples : Fe3+ / Fe2+ et Cu2+
/ Cu
a) Ecrire l'équation de la réaction susceptible de se produire entre le cuivre et les ions Fe3+.
b) Calculer le quotient de réaction initial associé à cette équation.
c) Déterminer le sens d'évolution spontanée de la réaction où K = 3,8.10 40.
Solution :
©Sciences Mont Blanc