Exercices Chap 11 – Les piles ![]()
ex 6 p 205
a)

b)

ex 7 p 205

a) On utilise des solutions de sulfate de cuivre et de sulfate de nickel et des électrodes de cuivre et de nickel plongeant respectivement dans ces solutions reliées avec un pont salin.
b) L'électrode de nickel étant le pôle négatif, elle donne
des électrons : Ni(s) = Ni2+(aq)
+ 2 e-
L'autre électrode de cuivre est positive , elle récupère les électrons : Cu2+(aq) + 2 e- = Cu(s)
Equation globale : Ni(s) + Cu2+(aq) = Ni2+(aq) + Cu(s)
ex 8 p 205 :
pile avec les couples
: Cu2+ / Cu et Sn2+
/ Sn
a) dans le pont salin, les ions positifs vont vers la demi-pile Cu2+
/ Cu , cela signifie que cette demi-pile consomme des ions positifs Cu2+
électrode de cuivre : Cu2+(aq) + 2 e- = Cu(s) électrode d'étain : Sn(s) = Sn2+(aq) + 2 e-
équation globale : Cu2+(aq) + Sn(s) = Cu(s) + Sn2+(aq)
 |
ex 9 p 205
a)
Le courant circule de l'électrode d'argent vers l'électrode de plomb.
L'électrode d'argent est donc le pôle positif et l'électrode de plomb , le
pôle négatif.
Sa représentation formelle est :  Pb(s) / Pb2+(aq) // Ag+(aq)
/ Ag(s)
Pb(s) / Pb2+(aq) // Ag+(aq)
/ Ag(s) 
b) Pb(s) = Pb2+(aq) + 2 e- et Ag+(aq) + e- = Ag(s) ) x 2
c) Pb(s) + 2 Ag+(aq) = 2 Ag(s) + Pb2+(aq)
ex 10 p 205
a) Ag+(aq) + e- = Ag(s) b) AgCl (s) + e- = Ag(s) + Cl- (aq)
c) Fe(s) = Fe2+(aq) + 2 e- ⇒ 2 AgCl (s) + Fe(s) = Fe2+(aq) + 2 Cl- (aq) + 2 Ag(s) K = 1022
d)
Qri = [Fe2+ ]i.[Cl- ]2i
= 1,0.10-5 x (1,0.10-5)2 = 1,0.10-15 <
K
⇒ La transformation évolue dans le sens direct.
L'électrode d'argent est le lieu d'une réduction, elle consomme des électrons
, elle est positive.
L'électrode de fer est le lieu d'une oxydation, elle donne des électrons,
elle est négative.
ex 11 p 206
Ag+(aq) + e- = Ag(s) et Cr(s) = Cr3+(aq) + 3 e-
on multiplie la 1ère demi-équation par 3 pour équilibrer les électrons .
3 Ag+(aq) + Cr(s) = Cr3+(aq) + 3 Ag(s)
ex 12 p 206
Zn(s) = Zn 2+(aq) + 2 e- et Ni2+(aq) + 2 e- = Ni(s) ⇒ Zn(s) + Ni2+(aq) = Zn 2+(aq) + Ni(s)
Fe(s) = Fe2+(aq) + 2 e- et Pb2+(aq) + 2 e- = Pb(s) ⇒ Fe(s) + Pb2+(aq) = Fe3+(aq) + Pb(s)
Zn(s) = Zn 2+(aq) + 2 e- et Pb2+(aq) + 2 e- = Pb(s) ⇒ Zn(s) + Pb2+(aq) = Zn 2+(aq) + Pb(s)
Ni(s) = Ni2+(aq) + 2 e- et ( Ag+(aq) + e- = Ag(s) ) x 2 ⇒ Ni(s) + 2 Ag+(aq) = Ni2+(aq) + 2 Ag(s)
ex 13 p 206
a)

b) Fe(s) = Fe2+(aq) + 2 e- et Ni2+(aq) + 2 e- = Ni(s)
c) A l'électrode de fer, il se forme des ions Fe2+ . Des ions Ni2+ vont vers l'électrode de nickel.
Des ions sulfate SO42- traversent la paroi poreuse pour conserver l'électronégativité des solutions.
ex 14 p 206
a)
b)


c) A l'électrode de fer, Fe(s) = Fe2+(aq) + 2 e- et à l'électrode de cuivre , Cu2+(aq) + 2 e- = Cu(s)
d) équation globale : Fe(s) + Cu2+(aq) = Cu(s) + Fe2+(aq)
e)
Si on met en présence du fer métal et des ions Cu2+ , il
y a réaction chimique.
Si on met en présence du cuivre métal et des ions Fe2+ , il n'y
a pas de réaction chimique.
f)
La différence entre les deux cas est que dans la pile, les réactifs
sont séparés.
Dans une pile, le transfert d'électrons se fait par les conducteurs alors
qu'il est direct lorsque les réactifs sont en contact.
ex 15 p 206
a)

b) Zn = Zn 2+ + 2 e- à
l'électrode de fer et Pb2+ + 2 e- = Pb
à l'électrode de plomb
équation globale : Zn + Pb2+ = Zn 2+ + Pb
L'électrode de zinc donne des électrons, elle est donc négative.
L'électrode de plomb est donc positive.
ex 16 p 206
a)

On teste la présence d'ions Cl- dans le compartiment de l'électrode de zinc, cela signifie qu'il y a production d'ions positifs et le pont salin fournit des ions Cl- pour neutraliser la solution.
Des ions Zn 2+ sont donc formés.
d) L'électrode de zinc fournit des électrons, elle est donc négative. L'électrode de nickel est donc positive.
e)  Zn / Zn2+
// Ni2+ / Ni
Zn / Zn2+
// Ni2+ / Ni  ou
ou  Zn / Zn2+ // KCl(aq) // Ni2+ / Ni
Zn / Zn2+ // KCl(aq) // Ni2+ / Ni 
ex 17 p 206
a)

La concentration en ions sulfate augmente du côté où il y a production d'ions positifs pour neutraliser la solution.
Il y a donc formation d'ions Zn 2+ .
b) L'électrode de zinc est oxydé en ions Zn 2+
c) Zn + Pb2+ = Zn 2+ + Pb
d) L'électrode de zinc fournit des électrons, elle est donc négative. L'électrode de fer est positive.
ex 18 p 207
a) on peut utiliser les couples Ag+(aq) / Ag et Zn 2+(aq) / Zn pour constituer une pile.
b)

c) On n'a pas mentionné un pont salin ou une paroi poreuse pour assurer la conduction.
ex 19 p 207

 a)
a)
b) on choisit le métal platine
c)
d) Il faut rajouter un pont salin

ex 20 p 207

a) Le courant circule du cuivre vers le fer. Le pôle positif est donc le cuivre et l'électrode de fer est donc négative.
b) Les ions nitrate vont vers le côté où des ions positifs sont formés pour neutraliser la solution.
L'électrode de fer est négative, le métal fer est donc oxydé en ions Fe2+ .
c) L'électrode de cuivre est positive, elle reçoit des électrons, elle est le lieu d'une réduction.
d) Fe = Fe2+ + 2 e- et Cu2+ + 2 e- = Cu ⇒ Fe + Cu2+ = Fe2+ + Cu
e)
C'est le réducteur le plus fort qui réagit sur l'oxydant le plus fort.
Le réducteur le plus fort est donc le métal fer.
f) L'oxydant le plus fort est donc l'ion Cu2+
ex 21 p 207
a)
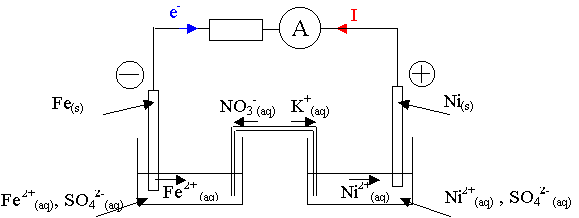
b) Les électrons circulent dans le circuit extérieur en sens inverse du courant, du pôle négatif au pôle positif, du fer au nickel.
c) L'électrode négative libère des électrons, c'est donc le métal fer.
d) A l'électrode de nickel, les ions Ni2+ captent les électrons.
e) Une solution ionique est conductrice.
ex 22 p 207
a) Fe(s)
+ Ni2+(aq)= Fe2+(aq)+ Ni(s) K = 2.106 Qri = [Fe2+ ]i
/ [Ni2+ ]i = 1 <
K
la transformation évolue donc dans le sens direct. Le métal fer est donc oxydé
en ions Fe2+ .
L'électrode de fer est donc négative et l'électrode de nickel est donc positive.
b) Qri = [Fe2+ ]i / [Ni2+ ]i = 0,3 / 1,0.10-7 = 3,0.106 > K , l'évolution est donc dans le sens inverse.
La polarité de la pile est donc inversée.
ex 23 p 207
a) couples : Ag+(aq) / Ag(s) et Fe3+(aq) / Fe2+(aq)
b) Ag+(aq) + e- = Ag(s) et Fe3+(aq) + e- = Fe2+(aq)
c) Qri = = [Fe3+ ]i / ([Fe2+ ]i.[Ag+ ]i) = 0,1 / (0,2 x 0,2) = 2,5 < K , évolution dans le sens direct.
d)
Qri = = [Fe3+ ]i / ([Fe2+
]i.[Ag+ ]i) = 0,2 / (0,1 x 0,2) = 10 >
K , évolution dans le sens inverse.
Le métal platine capte des électrons pour réduire les ions Fe3+ en Fe2+ .
Les électrons circulent donc de l'électrode d'argent vers l'électrode de platine.
©Sciences Mont Blanc

