Exercices – Chap 14 –Estérification et hydrolyse ![]()
ex 6 p 259
Il faut retrouver le groupe ester : – CO – O – . Les molécules b, d, f et g sont des esters.
ex 7 p 259
a) méthanoate de propyle b) 2-méthylpropanoate d'éthyle
c) benzoate de 1-méthyléthyle d) propanoate de méthyle
e) propanoate de 1,1-diméthyléthyle
ex 8 p 259
Pour le propanoate d'éthyle (b ex 6) , il faut de l'acide propanoïque et de l'éthanol.
Pour le benzoate de méthyle (d ex 6) , il faut de l'acide benzoïque et du méthanol.
Pour le méthanoate de 1-méthyléthyle (f ex 6) , il faut de l'acide méthanoïque et du propan-2-ol.
Pour le 2-méthylpropanoate de méthyle (g ex 6) , il faut de l'acide 2-méthylpropanoïque et du méthanol.
Pour le méthoate de propyle (a ex 7) , il faut de l'acide méthanoïque et du propan-1-ol.
Pour le 2-méthylpropanoate d'éthyle (b ex 7) , il faut de l'acide 2-méthylpropanoïque et de l'éthanol.
Pour le benzoate de 1-méthyléthyle (c ex 7) , il faut de l'acide benzoïque et du propan-2-ol.
Pour le propanoate de méthyle (d ex 7) , il faut de l'acide propanoïque et du méthanol.
Pour le propanoate de 1,1-diméthyléthyle (e ex 7) , il faut de l'acide propanoïque et
du 2-méthylpropan-2-ol.
ex 9 p 259
a) isomères esters de C4H8O2 : CH3-CH2-CO-O-CH3 propanoate de méthyle
CH3-CO-O- CH2-CH3 éthanoate d'éthyle ;
H-CO-O- CH2 -CH2-CH3 méthanoate de propyle ;
H-CO-O- CH(CH3)2 méthanoate de 1-méthyléthyle
b) isomères esters de C5H10O2 : CH3-CH2-CH2-CO-O-CH3 butanoate de méthyle
CH3-CH2-CO-O- CH2-CH3 propanoate d'éthyle ;
(CH3)2CH2-CO-O-CH3 2-méthylpropanoate de méthyle ;
CH3-CO-O- CH2-CH2-CH3 éthanoate de propyle ;
CH3-CO-O- CH(CH3)2 éthanoate de 1-méthyléthyle ;
H-CO-O- CH2 -CH2-CH2-CH3 méthanoate de butyle ;
H-CO-O- CH2 -CH(CH3)2 méthanoate de 2-méthylpropyle
H-CO-O- CH(CH3) –CH2 -CH3 méthanoate de 1-méthylpropyle
H-CO-O- C(CH3)3 méthanoate de 1,1-diméthyléthyle
ex 10 p 259
D'après la formule, c'est un ester de l'acide benzoïque pour le groupe du bas à droite et du méthanol pour le groupe en haut à droite.
ex 11 p 260
a) C'est un ester dérivé de l'acide éthanoïque et du phénol .
b) Par hydrolyse , on obtient l'acide éthanoïque et le phénol.
c) L'acide éthanoïque est un acide carboxylique mais le phénol ne fait pas partie des alcools mais des phénols ( le groupe OH n'est pas porté par un carbone saturé)
ex 12 p260
a) En haut à droite , il y a un groupe acide et en bas un groupe ester.
b) Par hydrolyse, on obtient l'acide éthanoïque et HO – C6H4 – CO – OH (acide salicylique)
c) On obtient de l'acétylsalicylate de méthyle : CH3 – CO – O – C6H4 – CO – O – CH3 et de l'eau.
ex 13 p 260
a) CH3 – CO – O – CH2 – C6H5
b) CH3 – CO – OH(l) + C6H5 – CH2 – OH(l) = CH3 – CO – O – CH2 – C6H5 (l) + H2O(l)
ex 14 p 260
a) Par hydrolyse, on obtient l'acide éthanoïque CH3-COOH et HO – C6H4 – CO – OH
(acide salicylique. Formule du salicylate de méthyle : HO – C6H4 – CO – O – CH3
Formule du salicylate d'amyle : HO – C6H4 – CO – O – CH2 – CH2 – CH(CH3)2
b) HO – C6H4 – COOH + CH3 – OH = HO – C6H4 – CO – O – CH3 + H2O
c) HO – C6H4 – CO – O – CH2 – CH2 – CH(CH3)2 + H2O
= HO – C6H4 – COOH + HO – CH2 – CH2 – CH(CH3)2
ex 15 p 260
a) Seul (B) est un ester, (C) est un anhydride d'acide et (A) est un acide carboxylique.
b) Un ester doit posséder le groupe – CO – O – .
ex 16 p 260
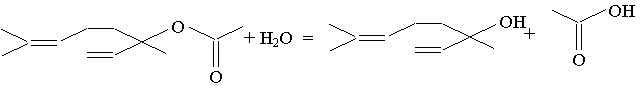
a) A est un ester, son hydrolyse donne un acide carboxylique et un alcool.
b) Cette transformation est une hydrolyse :
c) 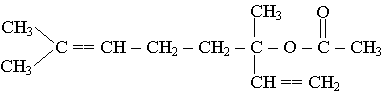
ex 17 p 260
a) (A) C6H5 – CH2 – CH2 – OH (+ K+,MnO4- ) ⇒ C6H5 – CH2 – COOH (B) acide
b) C6H5 – CH2 – CH2 – OH + H2O = C6H5 – CH2 – COOH + 4 H+ + 4 e-
MnO4- + 8 H+ + 5 e- = Mn2+ + 4 H2O
5 C6H5 – CH2 – CH2 – OH + 4 MnO4- + 12 H+ = 5 C6H5 – CH2 – COOH + 4 Mn2+ + 11 H2O
c) C6H5 –CH2 –CH2 –OH+ C6H5 –CH2 –COOH = C6H5 –CH2 –COO–CH2 –CH2 –C6H5 + H2O
d) Cette réaction est une estérification, elle est lente et limitée.
ex 18 p 260
(A) C4H8O2 A + H2O = B + C B + C + MnO4- ⇒ B
a) D'après l'énoncé , la molécule B est un acide, C est un alcool et la 1ère réaction est une hydrolyse d'un ester A.
b) Pour obtenir un seul acide à la fin, il faut que B et C aient le même nombre d'atomes de C : 2
A : CH3 – CO – CH2 – CH3 ; B : CH3 – COOH et C : CH3 – CH2 – OH
c) CH3 – CO – CH2 – CH3 + H2O = CH3 – COOH + CH3 – CH2 – OH ( hydrolyse )
d) 5 CH3 – CH2 – OH + 4 MnO4- + 12 H+ = 5 CH3 – COOH + 4 Mn2+ + 11 H2O
ex 19 p 261
1) a) MA = 74 g.mol-1 ; la formule brute d'un alcool est CnH2n+2O
MA = n.MC + (2n+2).MH + MO = 12n + 2n + 2 + 16 = 14n + 18 = 74 ⇒ n = (74 – 18)/ 14 = 4
A : C4H10O
b) B réagit avec la DNPH , c'est donc un aldéhyde ou une cétone, mais B ne réagit pas avec la liqueur de Fehling ni le réactif de Tollens, il s'agit donc d'une cétone. Le groupe OH de l'alcool n'est donc pas en bout de chaîne.
Possibilités pour A : CH3 – CH(OH) – CH2 – CH3 butan-2-ol ou CH3 – C(CH3)(OH) – CH3 2 – méthylpropan-2-ol ,
mais celui-ci ne s'oxyde pas car l'atome de carbone portant le groupe OH n'a pas d'atome d'hydrogène.
Solution (A) : CH3 – CH(OH) – CH2 – CH3 butan-2-ol.
MnO4- + 8 H+ + 5 e- = Mn2+ + 4 H2O
CH3 – CH(OH) – CH2 – CH3 = CH3 – CO – CH2 – CH3 + 2 H+ + 2 e-
5 CH3 –CH(OH) –CH2 –CH3 + 2 MnO4- + 6 H+ = 5 CH3 –CO–CH2 –CH3 + 2 Mn2+ + 8 H2O
(B) butan-2-one ou butanone ( il n'y en a pas d'autre)
2) R-COOH + CH3 – CH(OH) – CH2 – CH3 = C5H10O2 + H2O
a) Cette réaction est une estérification, réaction lente et limitée.
b) voir ci-dessus. Il y a déjà 4 atomes de carbone dans l'alcool, il n'en faut donc qu'un seul dans l'acide qui est donc l'acide méthanoïque, H-COOH .
(E) H – CO – O – CH(CH3) – CH2 – CH3 méthanoate de 1-méthylpropyle
ex 20 p 261
1) (A) C3H6O . Il réagit positivement à la DNPH et à la liqueur de Fehling, c'est donc un aldéhyde.
(A) CH3 – CH2 – CH = O propanal
2) On peut oxyder (A) en acide propanoïque (B) CH3 – CH2 – COOH
3) B + alcool primaire C → D ; MD = 116 g.mol-1
a) CH3 – CH2 – COOH + R-OH = CH3 – CH2 – COO – R + H2O
b) R– : CnH2n+1– MD = (3+n).MC + (5+2n+1).MH + 2 MO = 36 + 12n + 6 + 2n + 32 = 14n + 74
n = (116 – 74)/ 14 = 3 ⇒ (D) CH3 – CH2 – COO – CH2 – CH2 – CH3 propanoate de propyle
On peut écarter la formule CH3 – CH2 – COO – CH(CH3) – CH3 car l'alcool C serait secondaire.
c) alcool (C) : CH3 – CH2 – CH2 – OH propan-1-ol
ex 21 p 261
1) oxydation du 3-méthylbutan-1ol ⇒ (A) . L'alcool est primaire, il s'oxyde par oxydation du permanganate de potassium en acide carboxylique.
(alcool : CH3 – CH(CH3) – CH2 – CH2 – OH)
formule de (A) : CH3 – CH(CH3) – CH2 – COOH ( C5H10O2 )
2) a) Il peut y avoir une réaction entre l'alcool et l'acide, une estérification
b) CH3 – CH(CH3) – CH2 – COOH + CH3 – CH(CH3) – CH2 – CH2 – OH
= CH3 – CH(CH3) – CH2 – COO – CH2 – CH2 – CH(CH3) – CH3 (B) + H2O
3) malcool = 8,8 g , nalcool = m / M = 8,8 / (5 x 12 + 12 x 1 + 16) = 8,8 / 88 = 0,1 mol
mB = 4,0 g ; nB = mB / MB = 4,0 / ( 10 x 12 + 20 x 1 + 2 x 16) = 4,0 / 172 = 2,32.10-2 mol
alcool → acide (A) et alcool + acide (A) → ester (B)
nA = nalcool – 2 nB = 0,1 – 0,0464 = 0,0536 mol ,
mA = nA.MA = 0,0536 x (5 x 12 + 10 x 1 + 2 x 16) = 0,0737 x 102 = 5,47 g
ex 22 p 261
1ère étape :
1) L'ester formé : CH3 – CO – O – CH2 – CH2 – CH(CH3) – CH3
L'acide est donc CH3 – COOH acide éthanoïque
L'alcool est donc CH3 – CH(CH3) – CH2 – CH2 – OH 3-méthylbutan-1-ol , alcool primaire
2) CH3 – COOH + CH3 – CH(CH3) – CH2 – CH2 – OH
= CH3 – CO – O – CH2 – CH2 – CH(CH3) – CH3 + H2O
Cette réaction est lente et limitée.
3) V2 = m2 / ρ2 = n2.M2 / ρ2 ; V1 = m1 / ρ1 = n1.M1/ ρ 1 ⇒ n1 = V1.ρ1 / M1
n1 = 44,0.10-3 x 8,10.102 / (5 x12 + 12 x 1 + 16) = 0,405 mol = n2
V2 = n2.M2 / ρ2 = 0,405 x (2 x 12 + 4 x 1 + 2 x 16) / 1,05.103 = 23,1.10-3 L = 23,1 mL
4) La pierre ponce sert à réguler l'ébullition, éviter qu'elle ne s'emballe .
5) a) On ajoute de l'acide sulfurique pour catalyser la réaction.
L'équilibre est atteint plus vite sans être modifié.
b) On chauffe pour accélérer l'estérification, atteindre plus vite l'équilibre.
6) Le réfrigérant sert à condenser les vapeurs créées par l'ébullition du mélange réactionnel.
Cela évite les pertes de matière sous forme de vapeur tout en faisant la réaction sous pression atmosphérique car le montage reste ouvert en haut.
2ème étape :
 1)
Le mélange contient de l'alcool, de l'acide, de l'ester et de l'eau.
1)
Le mélange contient de l'alcool, de l'acide, de l'ester et de l'eau.
L'alcool et l'ester sont très peu solubles dans l'eau et forment une phase et l'eau et l'acide forment la phase aqueuse.
En étudiant les masses volumiques, on constate que le mélange alcool-ester est moins dense que la phase aqueuse, et se trouve donc au dessus de la phase aqueuse.
L'ester est donc dans la phase supérieure.
2) C est un chauffe-ballon, D est un ballon, E est une colonne à distiller, F est un réfrigérant et G est un erlenmeyer.
3) Lors de la distillation, il faut surveiller la température pour recueillir d'abord l'alcool qui distille à 128°C, puis on change de récipient pour recueillir l'ester qui distille à 143°C.
4) a) D'après l'équation, si la réaction était totale, nester = n1 = 0,405 mol
mester = nester.Mester = 0,405 x (7 x 12 + 14 x 1 + 2 x 16) = 0,405 x 130 = 52,6 g
b) rendement : r = mester formé / mester = 26,3 / 52,6 = 0,50 = 50 %
ex 23 p 262
butyrine : C15H26O6 ; 3 R – COOH + CH2(OH) – CH(OH) – CH2(OH) = C15H26O6 + 3 H2O
a) La butyrine est un ester avec 3 groupes ester.
b) En dehors des 3 groupes R- , il y a 6 atomes de carbone, il reste donc 9 atomes de carbone pour les 3 groupes R- , soit 3 atomes de carbone par groupe. L'acide est donc l'acide butanoïque.
Formule topologique Formule semi-développée de la butyrine
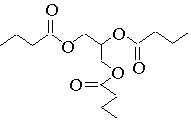
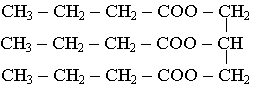
c) On observe l'hydrolyse de l'ester. L'acide sulfurique catalyse la réaction, l'accélère.
d) C15H26O6 + 3 H2O = 3 CH3 – CH2 – CH2 – COOH + CH2(OH) – CH(OH) – CH2(OH)
ex 24 p 262
1) a) Cette réaction est une estérification.
b) 
2) a) Si il y a une simple estérification, on forme : CH3 – COO – CH2 – CH2 – OH
Si l'estérification se fait sur les 2 groupes hydroxyle , on forme :
CH3 – COO – CH2 – CH2 – OOC – CH3
b) On utilise un excès d'acide éthanoïque.
2 CH3 – COOH + HO – CH2 – CH2 – OH = CH3 – COO – CH2 – CH2 – OOC – CH3 + 2 H2O
3) acide téréphtalique :
a) HO – CH2 – CH2 – OH
On peut accrocher des éthanediols de part et d'autre de l'acide ( ou inversement) et recommencer un très grand nombre de fois, on obtient ainsi une macromolécule :
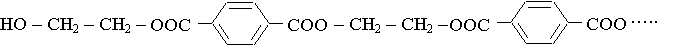 |
On note – A – le
groupe – CH2 – CH2 –
et – B – le groupe

La macromolécule peut alors s'écrire :
... – A – B – A – B – A – B – A – B – A – B – A – B – A – B – A – B – A – B – A – B – ...
b) C'est l'estérification qui se répète beaucoup ici.
c) Le motif de ce polymère est :
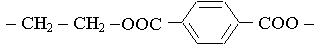
©Sciences Mont Blanc

